

醫(yī)療器械生產(chǎn)企業(yè)合規(guī)技術(shù)咨詢服務(wù)
注冊備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
186-0382-3910

第一類體外診斷試劑IVD(產(chǎn)品備案憑證)代理服務(wù)
根據(jù)《體外診斷試劑注冊管理辦法》(局令5號)的規(guī)定,第一類體外診斷試劑實(shí)行備案管理,體外診斷試劑備案是備案人向藥監(jiān)管理部門提交備案資料,藥監(jiān)管理部門對提交的備案資料...
服務(wù)價(jià):¥電議
好評系數(shù):

根據(jù)《體外診斷試劑注冊管理辦法》(局令5號)的規(guī)定,第一類體外診斷試劑實(shí)行備案管理,體外診斷試劑備案是備案人向藥監(jiān)管理部門提交備案資料,藥監(jiān)管理部門對提交的備案資料存檔備查。
備案資料符合要求的,藥監(jiān)管理部門應(yīng)當(dāng)當(dāng)場備案;備案資料不齊全或者不符合規(guī)定形式的,應(yīng)當(dāng)一次告知需要補(bǔ)正的全部內(nèi)容,由備案人補(bǔ)正后備案。對備案的體外診斷試劑,藥監(jiān)管理部門應(yīng)當(dāng)按照相關(guān)要求的格式制作備案憑證,并將備案信息表中登載的信息在其網(wǎng)站上予以公布。
注意:已備案的體外診斷試劑管理類別調(diào)整的,備案人應(yīng)當(dāng)主動(dòng)向食品藥品監(jiān)督管理部門提出取消原備案。
第一類IVD(產(chǎn)品備案)申報(bào)資料
(一)《第一類醫(yī)療器械備案表》;
(二)安全風(fēng)險(xiǎn)分析報(bào)告;
(三)產(chǎn)品技術(shù)要求;
(四)產(chǎn)品檢驗(yàn)報(bào)告;
(五)臨床評價(jià)資料;
(六)產(chǎn)品說明書及最小銷售單元標(biāo)簽設(shè)計(jì)樣稿;
(七)生產(chǎn)制造信息;
(八)證明性文件(原件):1、企業(yè)營業(yè)執(zhí)照;2、組織機(jī)構(gòu)代碼;
(九)符合性聲明:
1、聲明符合醫(yī)療器械備案相關(guān)要求;
2、聲明本產(chǎn)品符合第一類醫(yī)療器械產(chǎn)品目錄或相應(yīng)體外診斷試劑分類子目錄的有關(guān)內(nèi)容;
3、聲明本產(chǎn)品符合現(xiàn)行國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)并提供符合標(biāo)準(zhǔn)的清單;
4、聲明所提交備案資料的真實(shí)性。
第一類體外診斷試劑IVD(產(chǎn)品備案)辦事流程
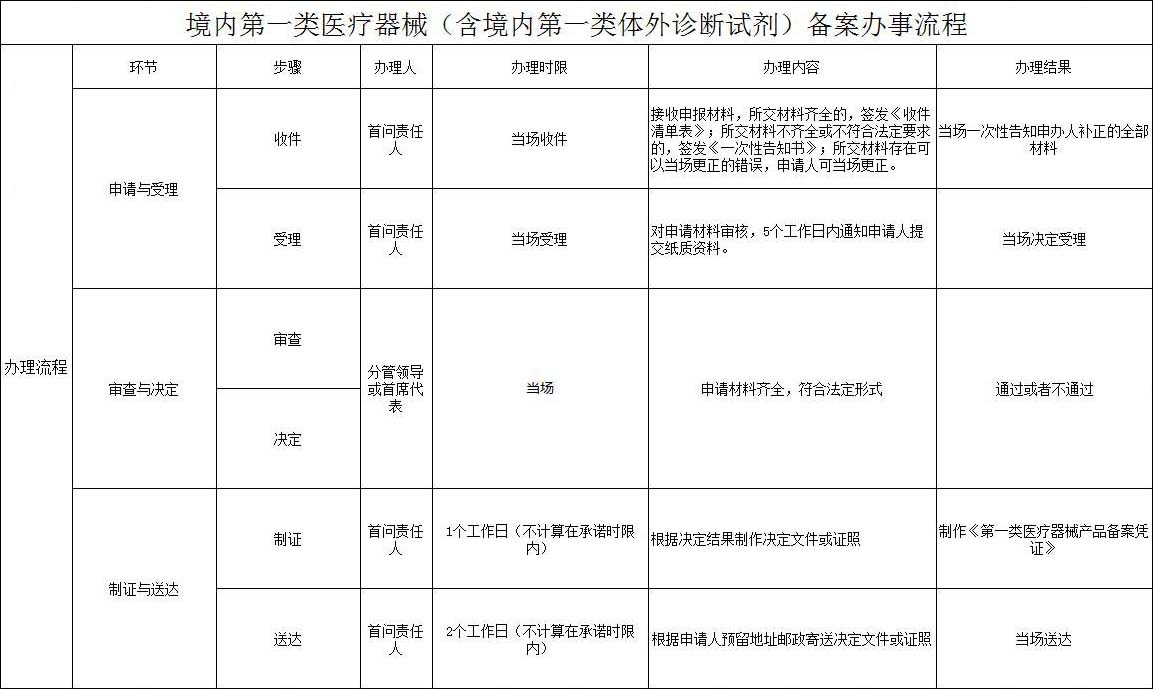
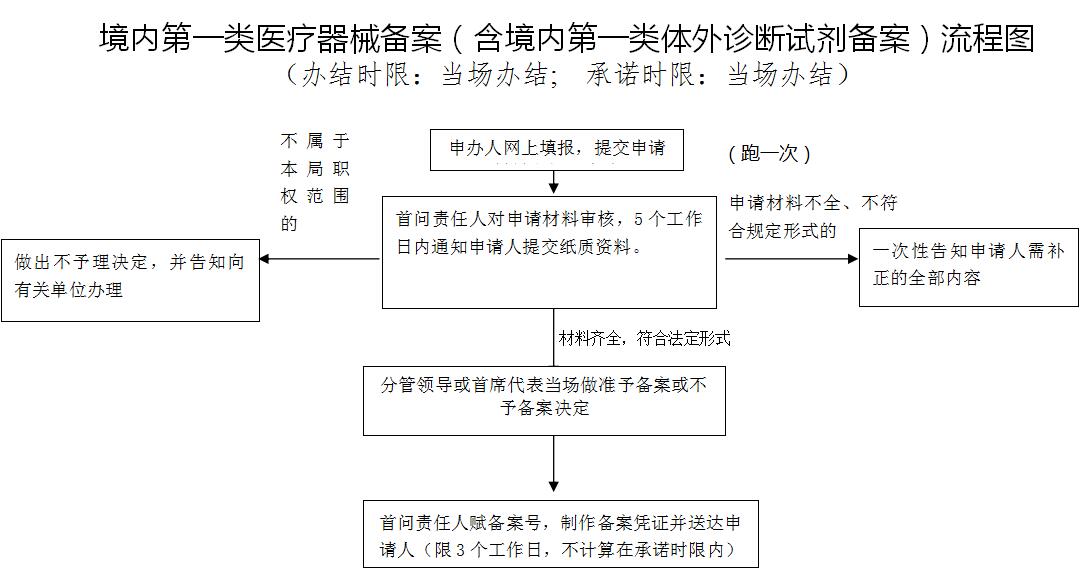
第一類IVD(產(chǎn)品備案)服務(wù)流程
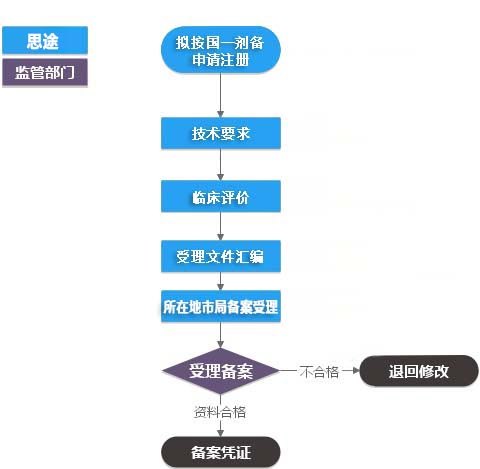
第一類IVD(產(chǎn)品備案)收費(fèi)標(biāo)準(zhǔn)
辦理第一類IVD(產(chǎn)品備案),官方不收取費(fèi)用。
第一類IVD(產(chǎn)品備案)辦理依據(jù)
| 文件名稱 | 文號 |
|---|---|
| 《醫(yī)療器械監(jiān)督管理?xiàng)l例》 | 650號文件 |
| 《藥監(jiān)總局關(guān)于第一類醫(yī)療器械備案有關(guān)事項(xiàng)的公告》 | 局14年26號 |
第一類IVD(產(chǎn)品備案)服務(wù)周期
立項(xiàng)階段
預(yù)算、合同、考慮期,7個(gè)工作日。
申請前資料準(zhǔn)備
資料提供:產(chǎn)品技術(shù)要求編制、產(chǎn)品備案資料編寫(含臨床評價(jià)資料),7個(gè)工作日。
申報(bào)后
產(chǎn)品備案受理,拿到備案憑證(當(dāng)場辦結(jié)),1個(gè)工作日。
*補(bǔ)正資料:若資料不齊全,須補(bǔ)正后再受理。
預(yù)算合計(jì)
客戶產(chǎn)品需自檢,思途承擔(dān)的接單、資料編制到遞交審核下證周期在15個(gè)工作日。
第一類IVD(產(chǎn)品備案)相關(guān)服務(wù)
| 產(chǎn)品備案資料編寫(含臨床評價(jià)資料) | 產(chǎn)品技術(shù)要求編制 |
| 產(chǎn)品備案資料發(fā)補(bǔ) | 延伸服務(wù):IVD生產(chǎn)備案代理 |

立即咨詢
 最新文章
最新文章 2025-09-16
2025-09-16 2025-09-16
2025-09-16 2025-09-16
2025-09-16 2025-09-16
2025-09-16 2025-09-16
2025-09-16 精選案例
精選案例
遠(yuǎn)紅外穴位貼/前列腺遠(yuǎn)紅外穴位貼臨床試驗(yàn)注冊案例
醫(yī)用疤痕/遠(yuǎn)紅外治療凝膠臨床試驗(yàn)注冊案例
脈沖磁場穴位治療儀同品種比對產(chǎn)品注冊案例

生物玻璃創(chuàng)面無機(jī)敷料醫(yī)療器械產(chǎn)品注冊證申辦案例

牙齒脫敏劑醫(yī)療器械注冊免臨床GMP案例

醫(yī)用冷凍箱醫(yī)療器械注冊免臨床體系建立案例

醫(yī)用冷藏箱醫(yī)療器械注冊GMP體系認(rèn)證案例
定制式活動(dòng)義齒醫(yī)療器械注冊證變更案例
醫(yī)用紅外額溫計(jì)(額溫槍)臨床驗(yàn)證注冊案例
下肢運(yùn)動(dòng)康復(fù)訓(xùn)練機(jī)產(chǎn)品注冊體系案例
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
-
多一份參考,總有益處
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
- 在線咨詢
- 在線客服
- 服務(wù)熱線
北京公司
186-0382-3911鄭州公司
186-0382-3910合肥公司
188-5696-0331 - 微信咨詢

- 返回頂部


 豫公網(wǎng)安備 41010202003160號
豫公網(wǎng)安備 41010202003160號