海南博鰲樂城國際醫(yī)療旅游先行區(qū)臨床急需進口藥品帶離先行區(qū)使用管理暫行辦法(瓊藥監(jiān)綜〔2020〕3號)
《海南博鰲樂城國際醫(yī)療旅游先行區(qū)臨床急需進口藥品帶離先行區(qū)使用管理暫行辦法》已經(jīng)3月24日海南博鰲樂城國際醫(yī)療旅游先行區(qū)領導小組會議審議通過,現(xiàn)印發(fā)給你們,請遵照執(zhí)行


注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2025-06-24 閱讀量:次

發(fā)布時間:2025-06-24
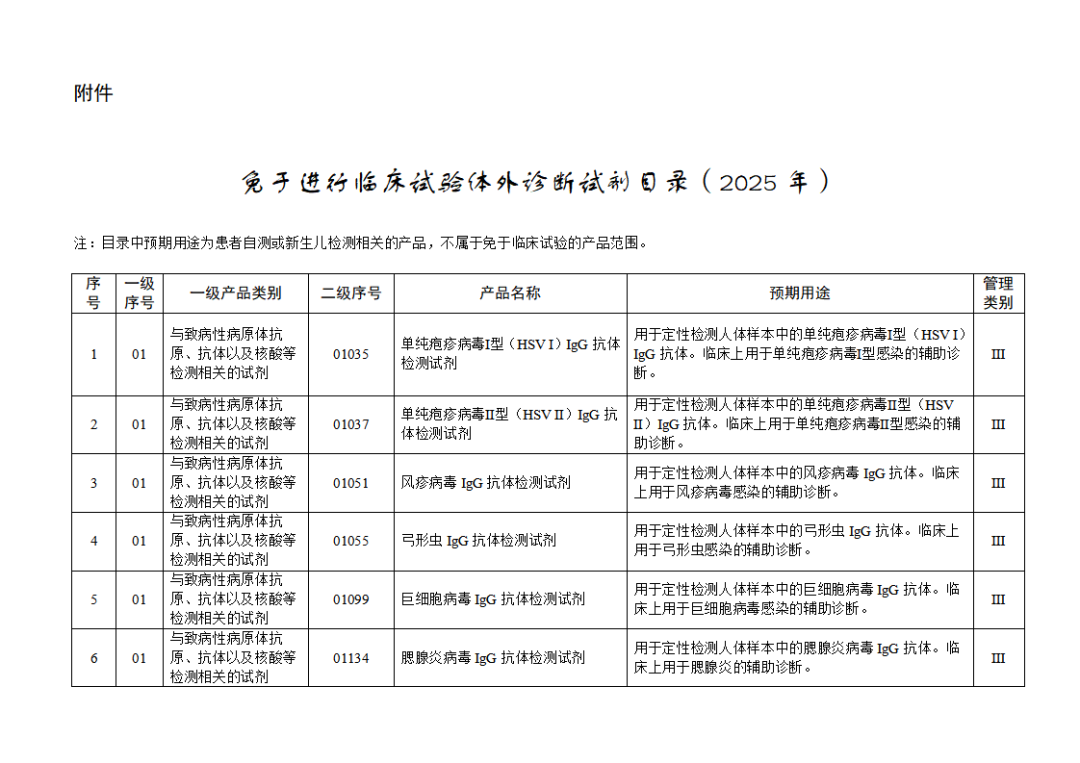
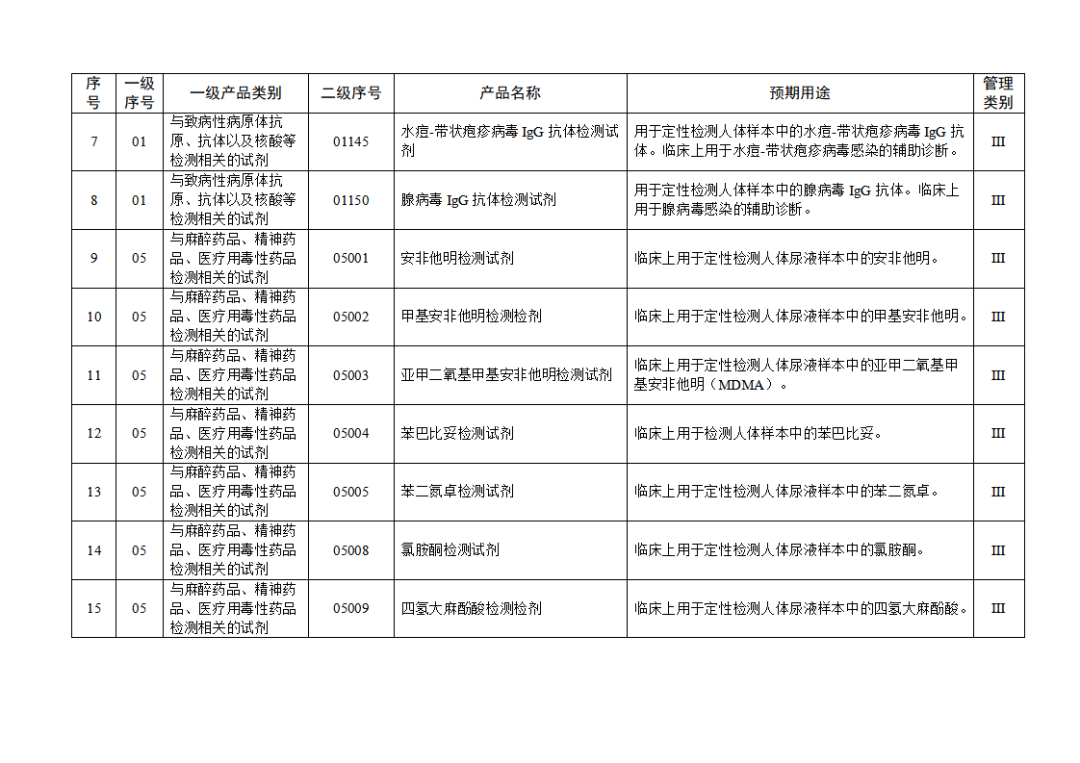
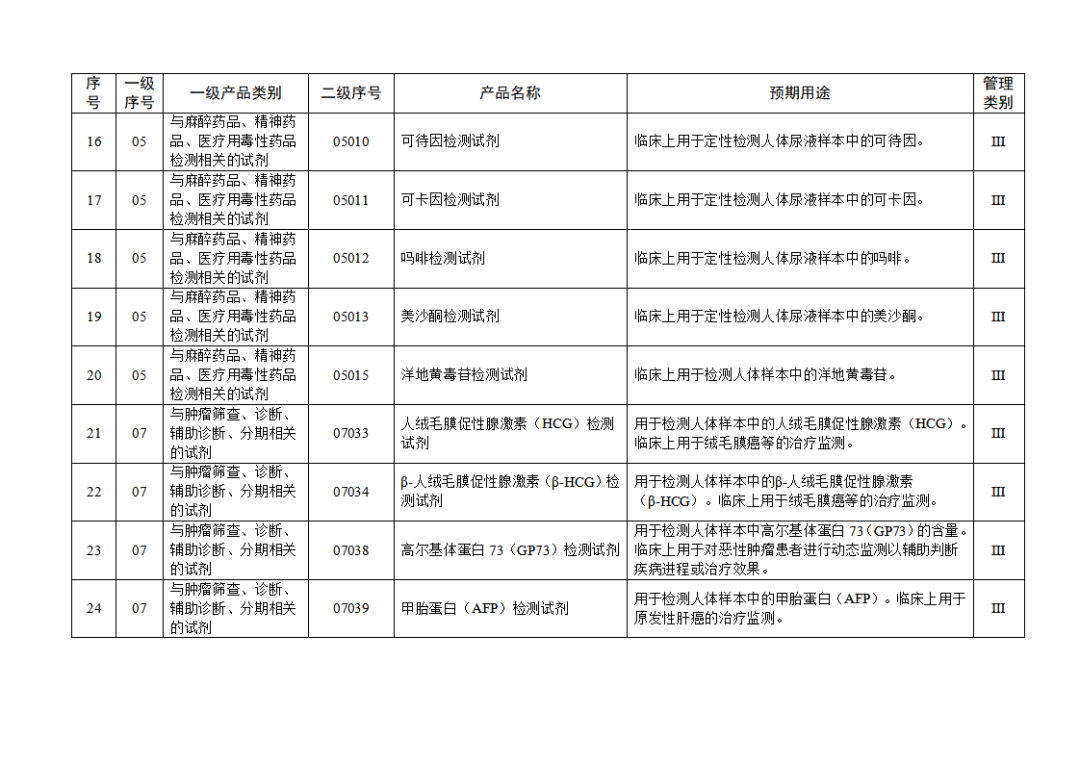
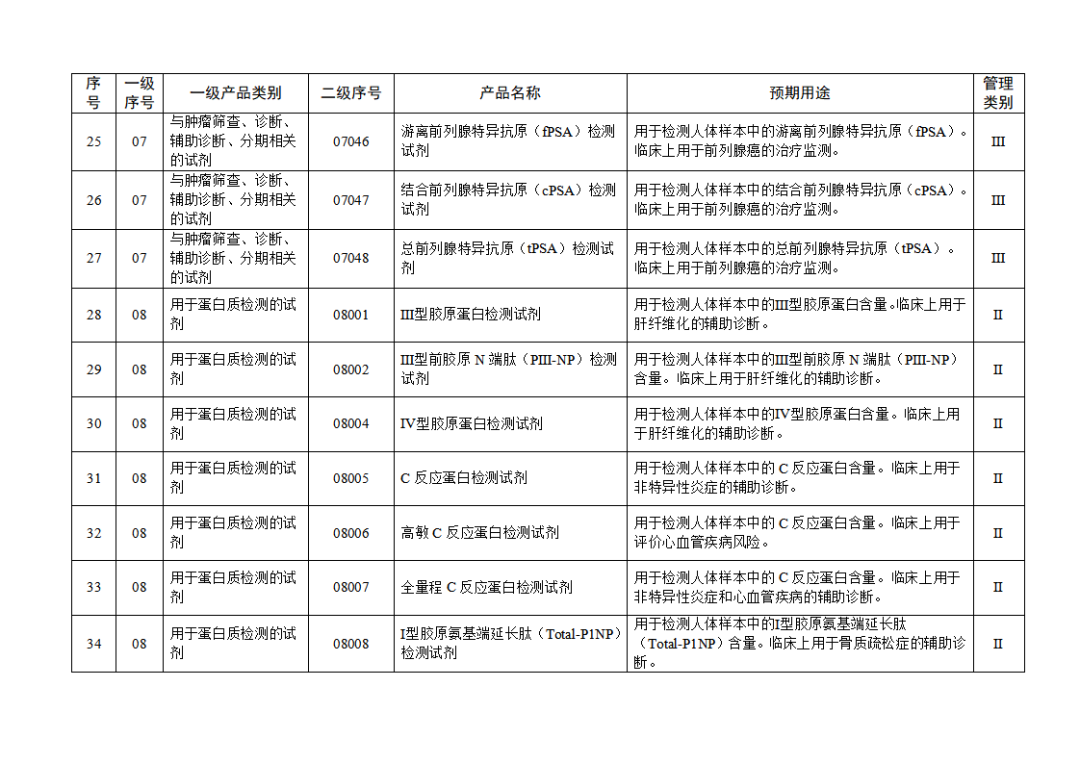
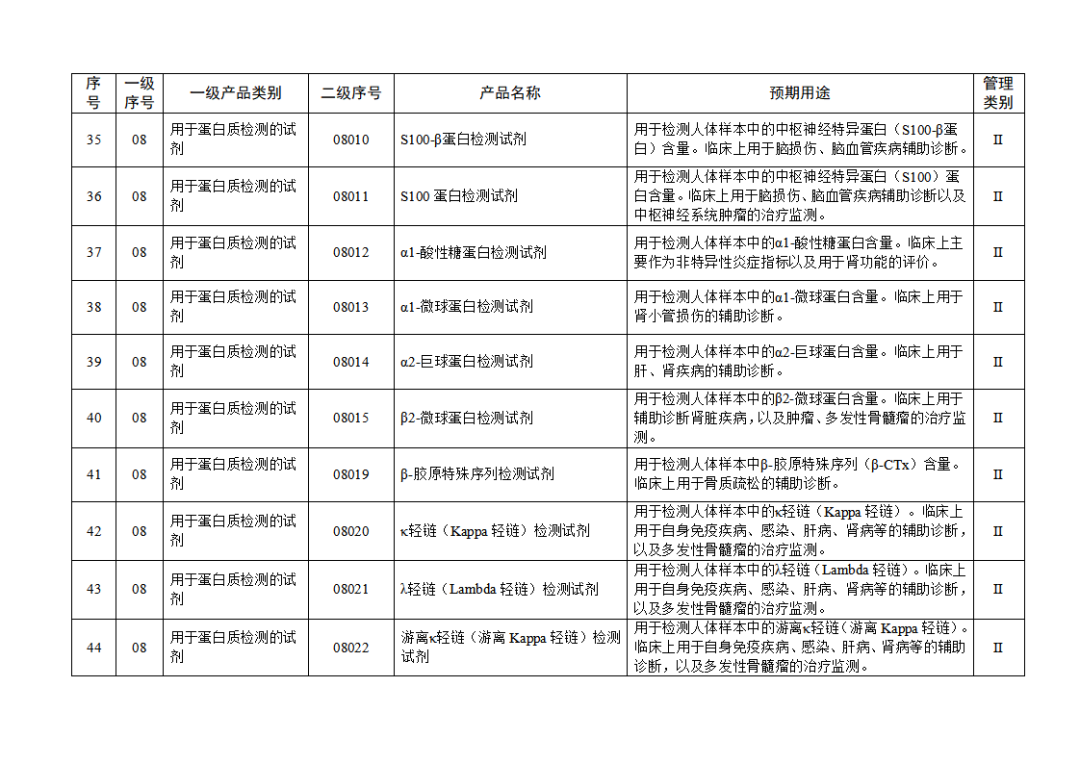
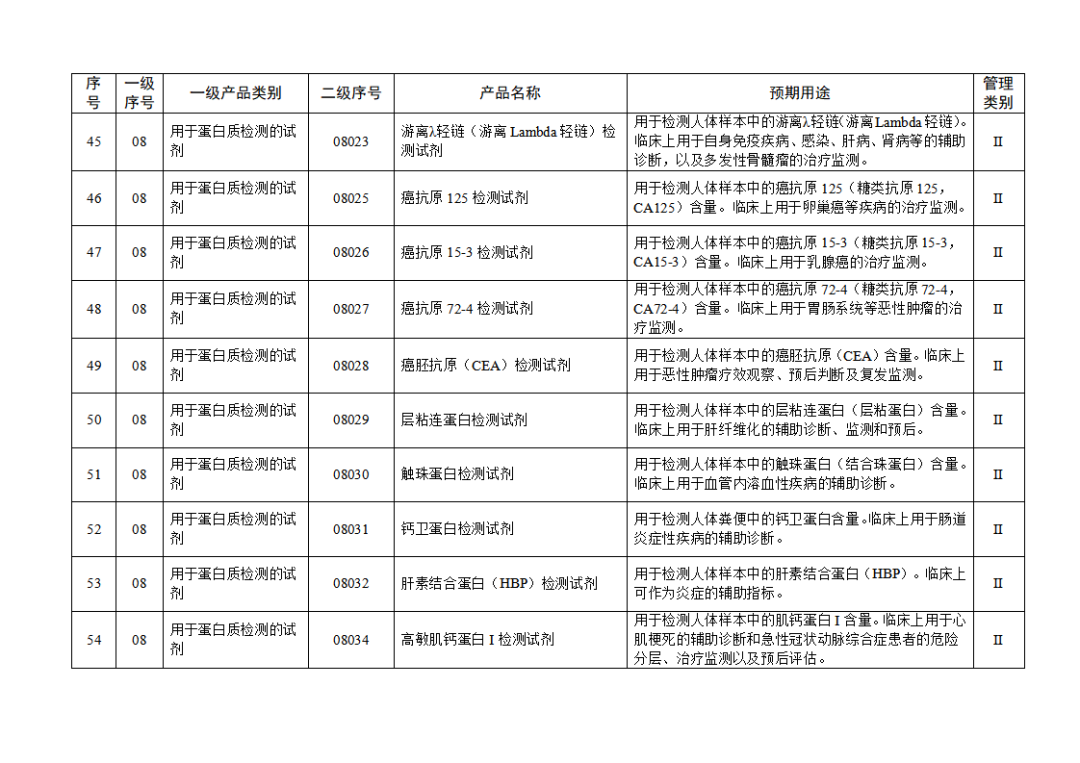
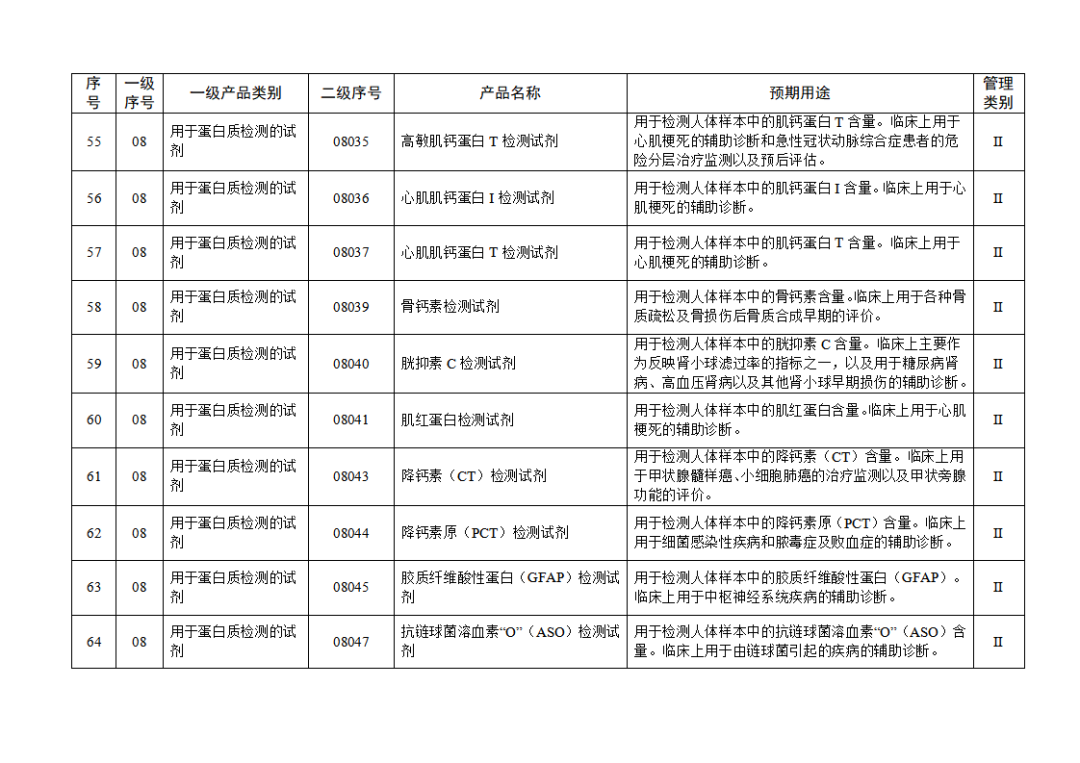
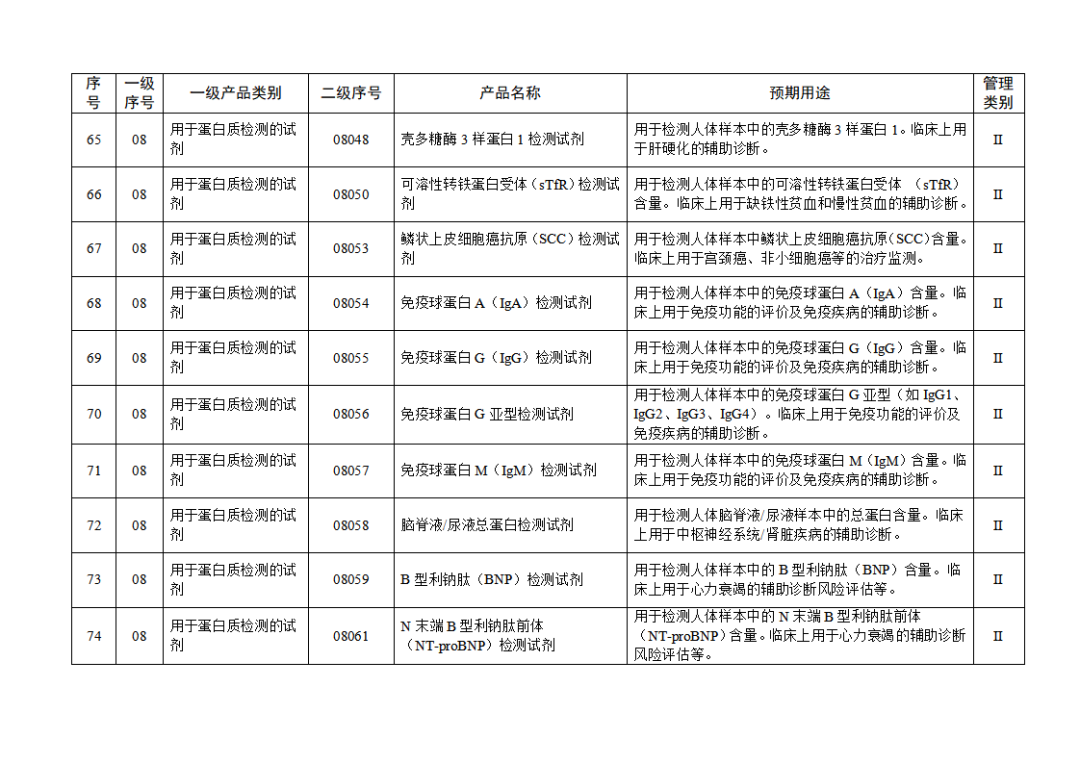
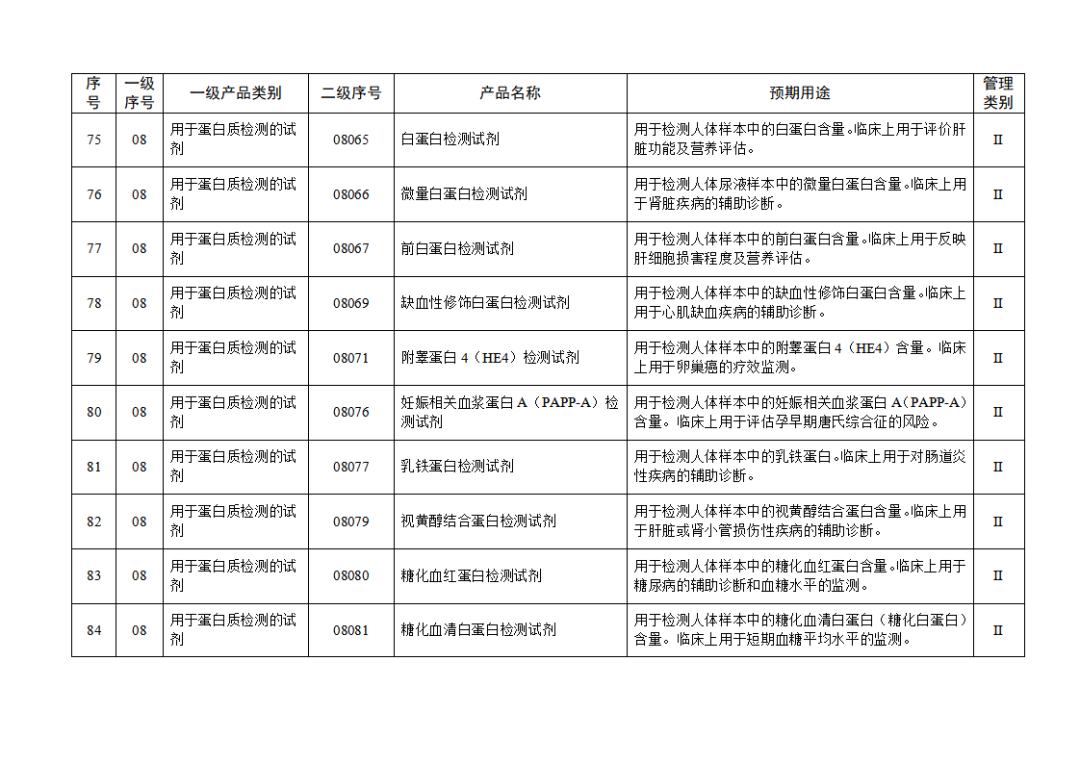
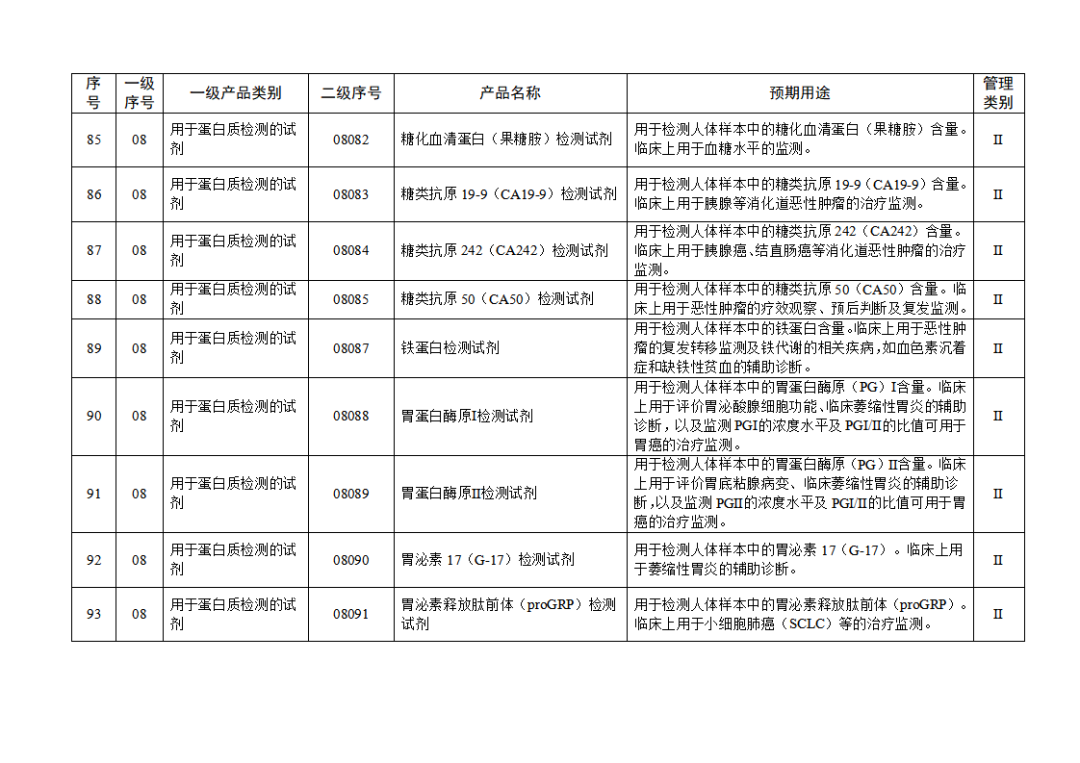
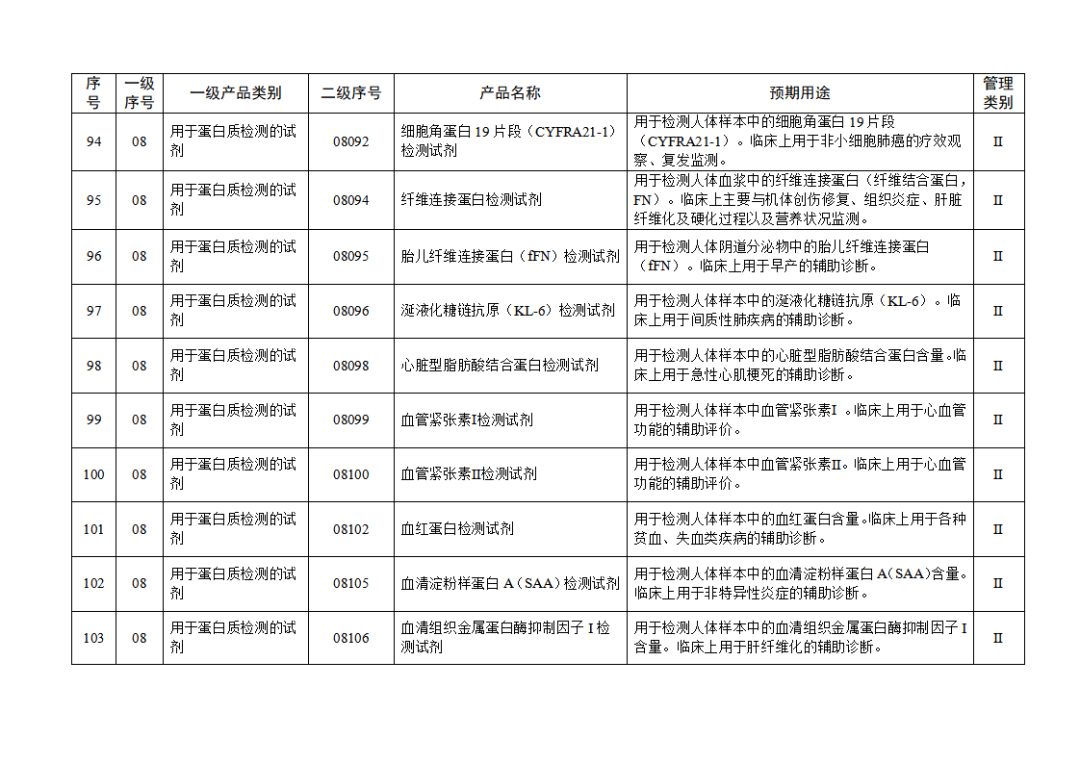
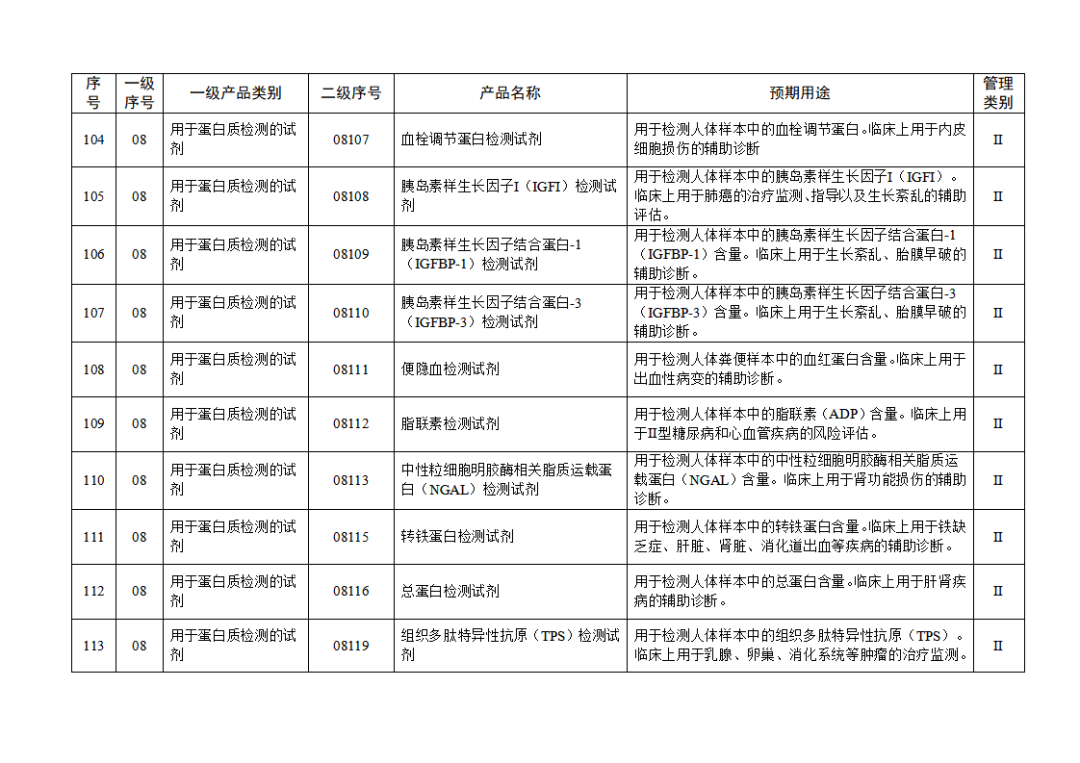
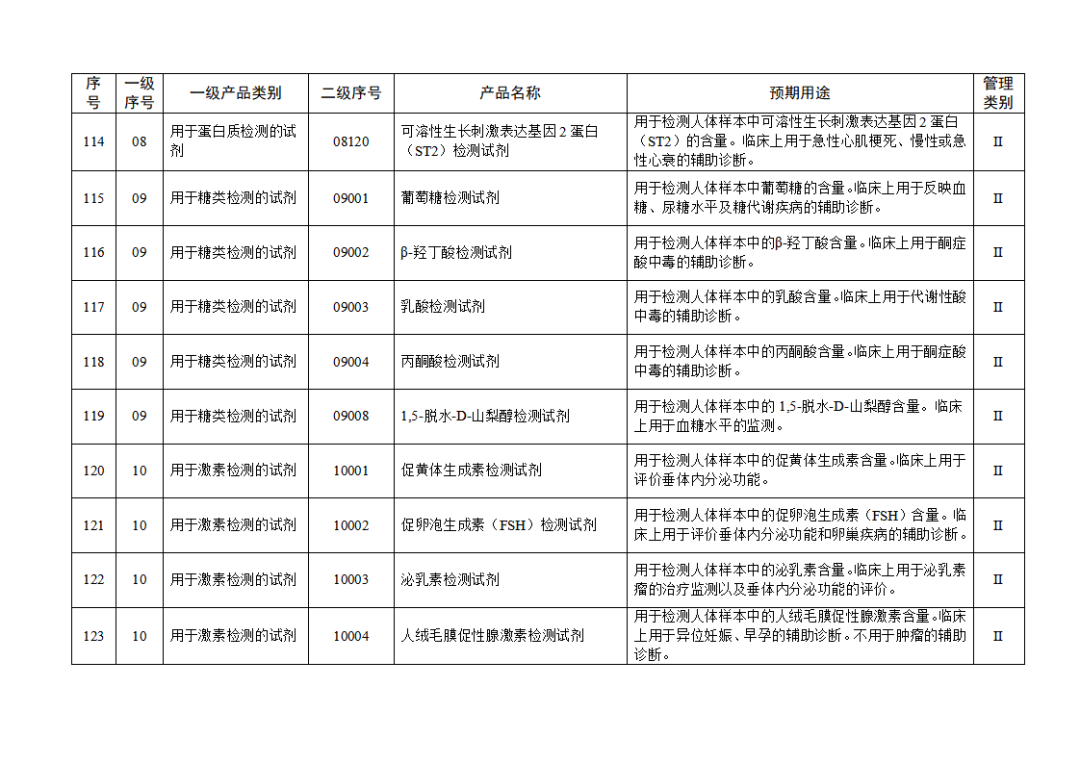
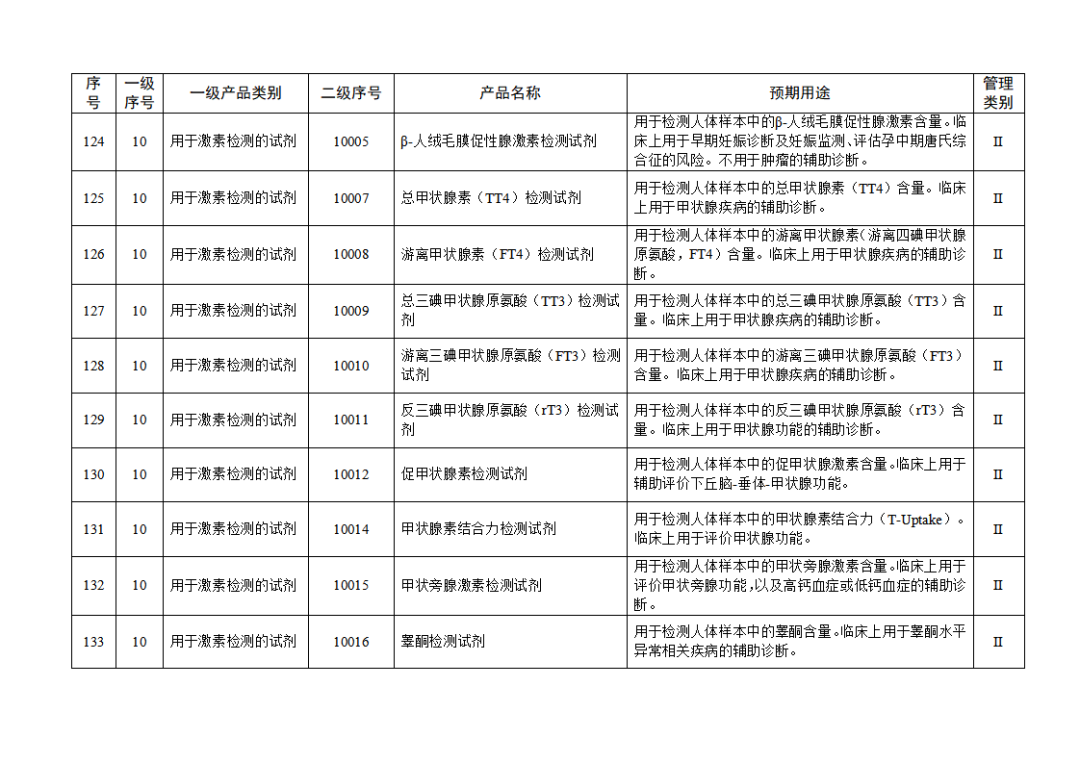
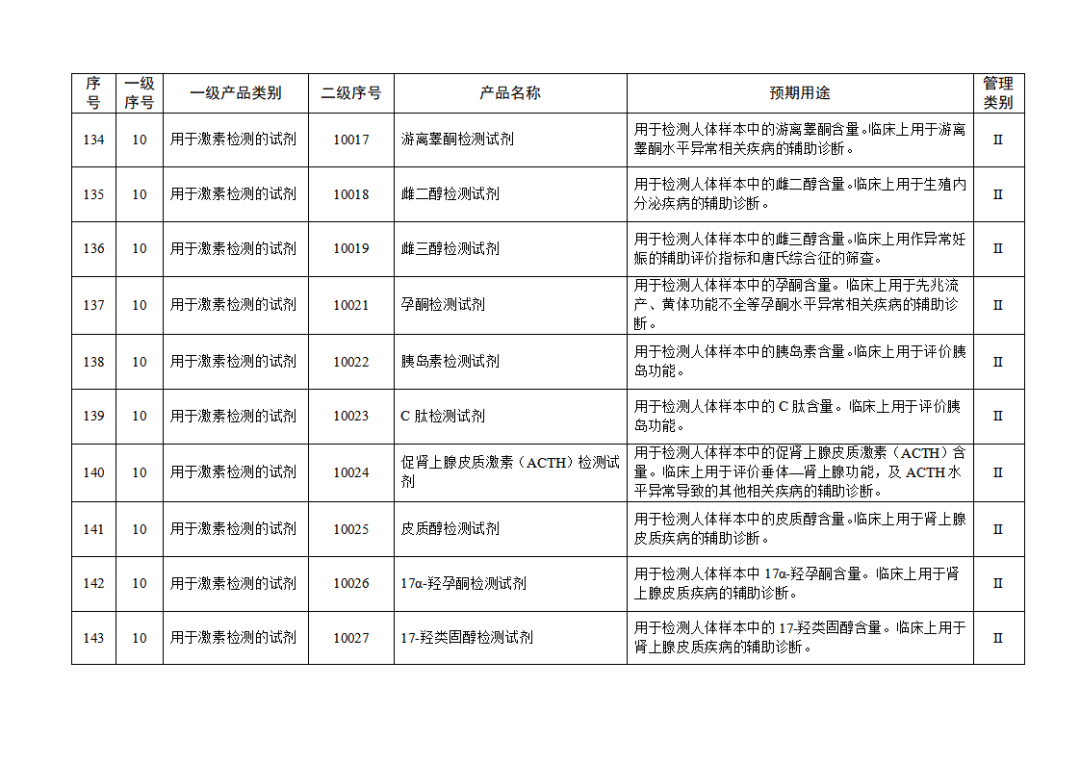
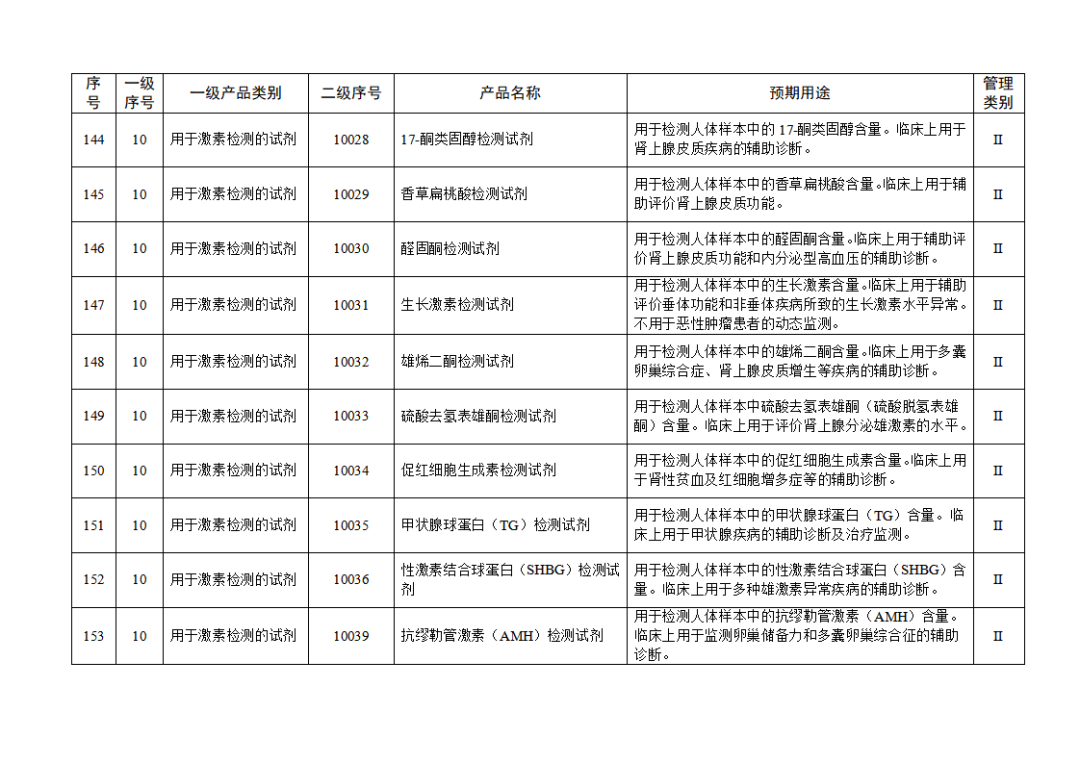
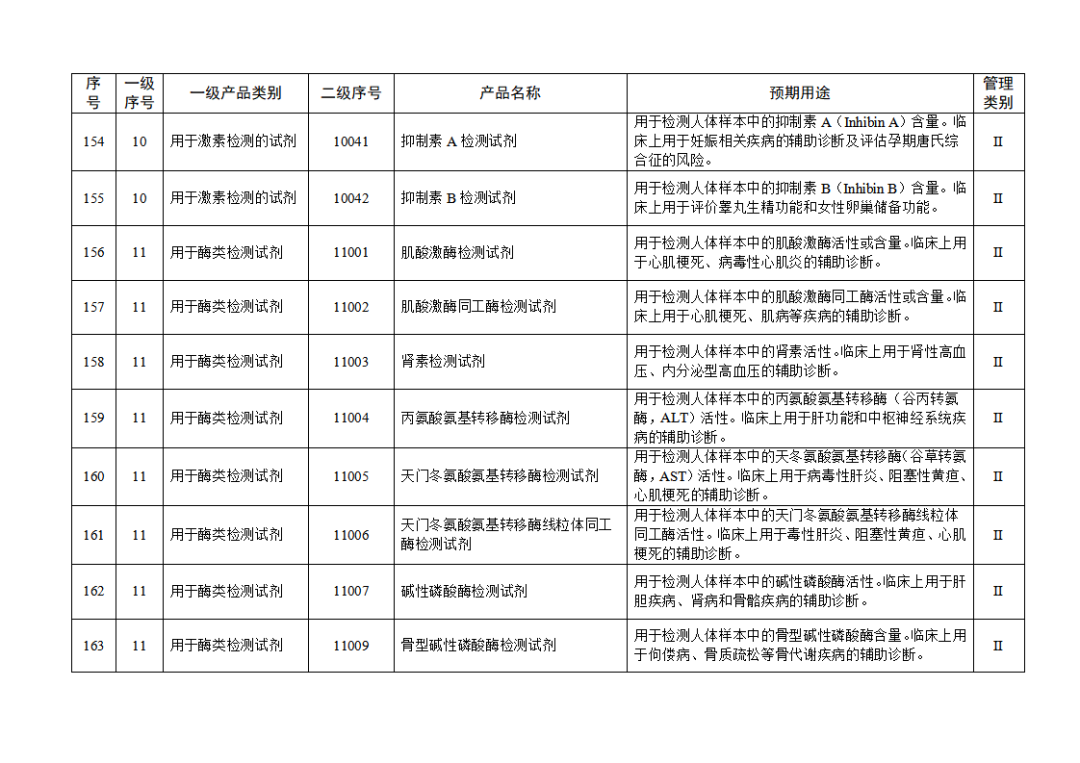
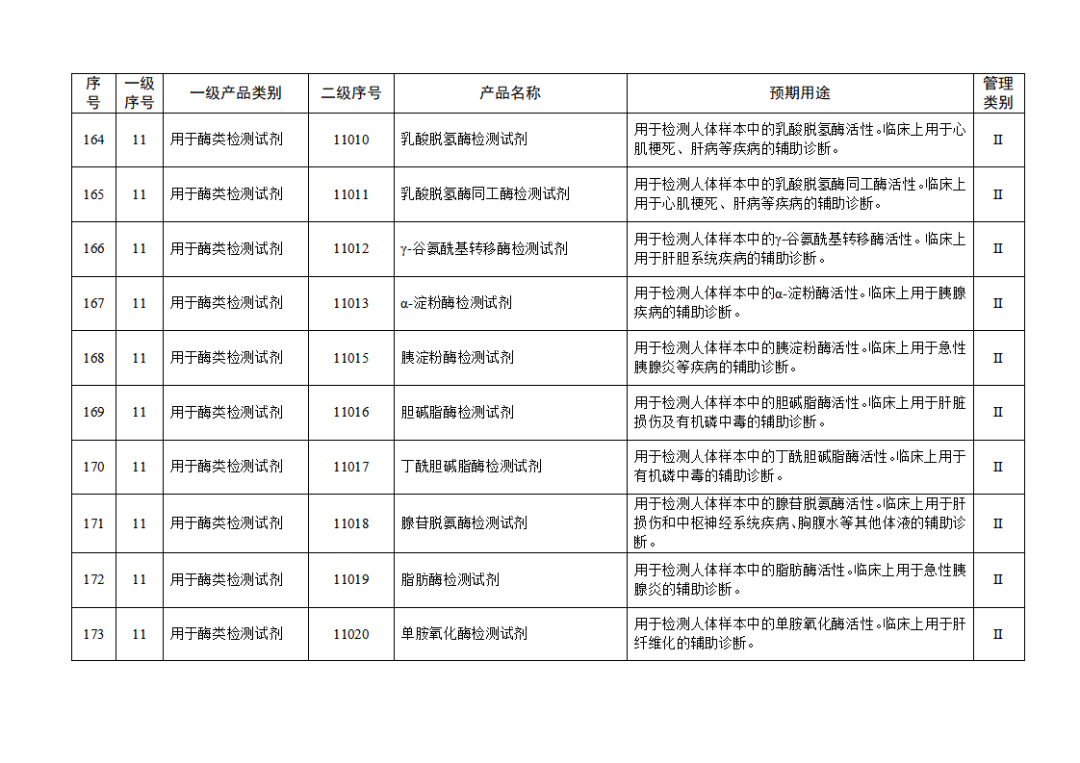
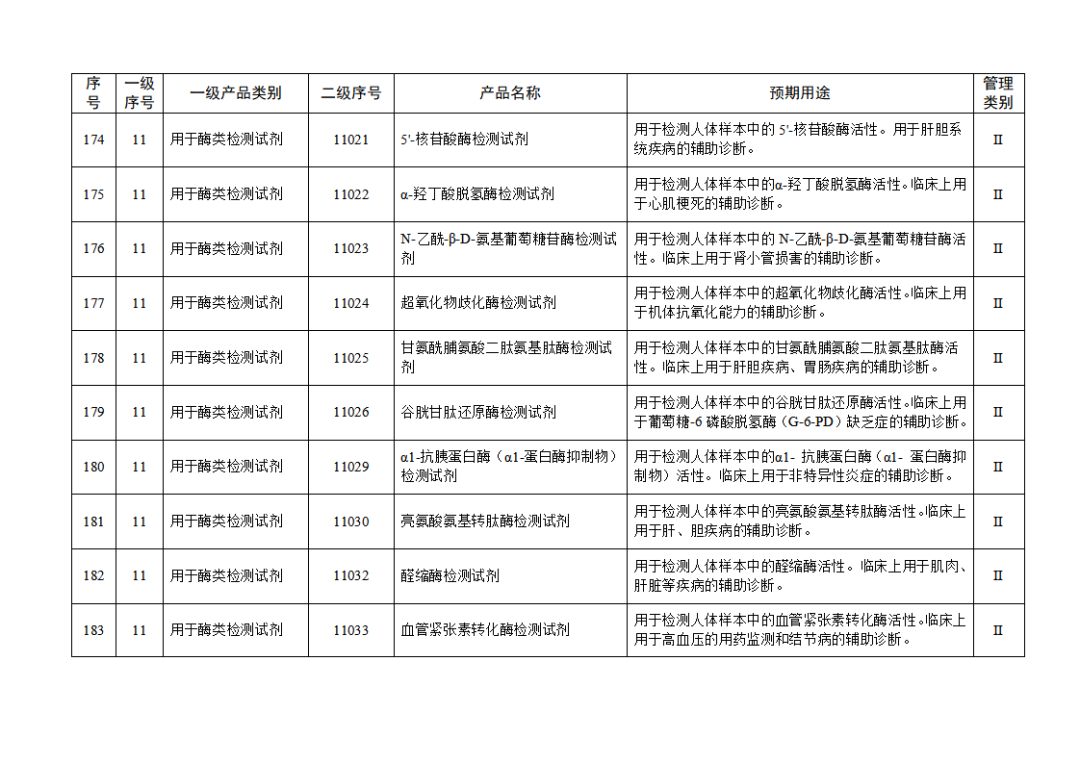
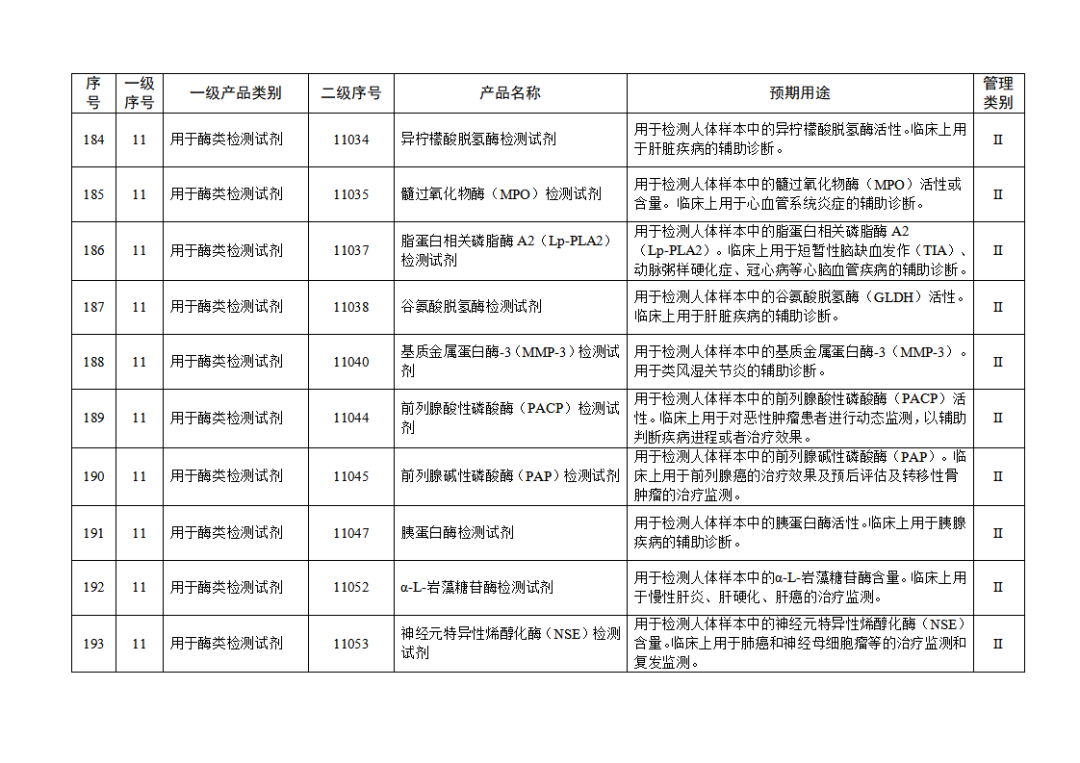
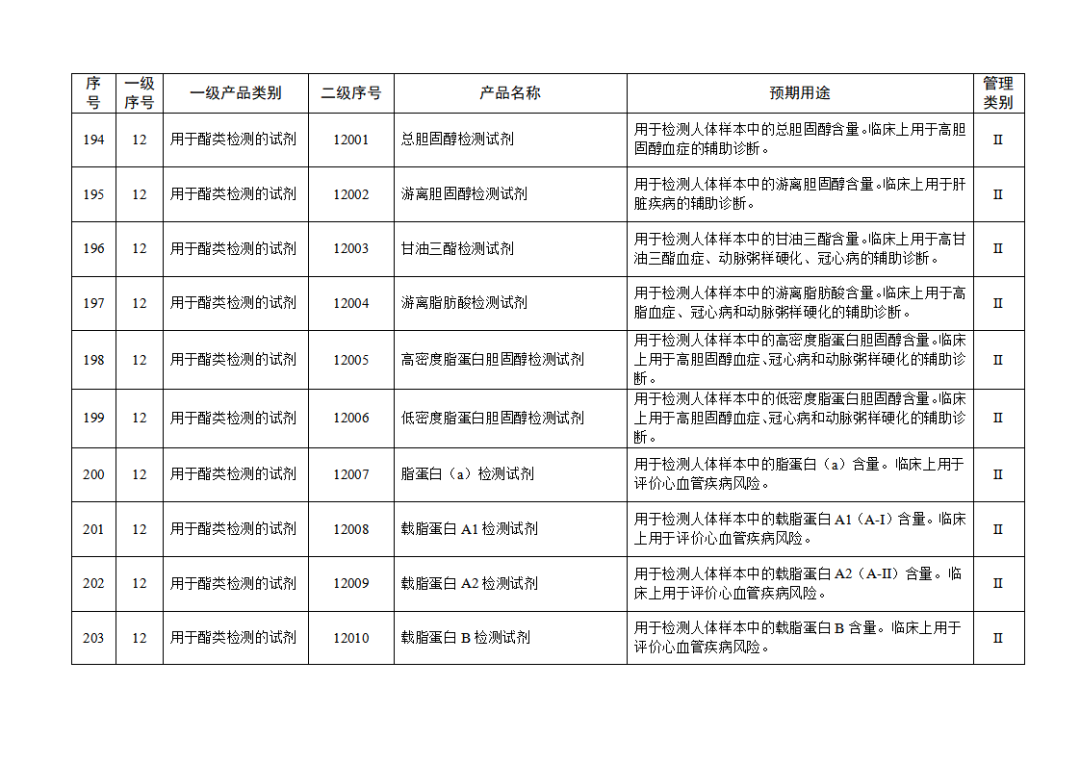
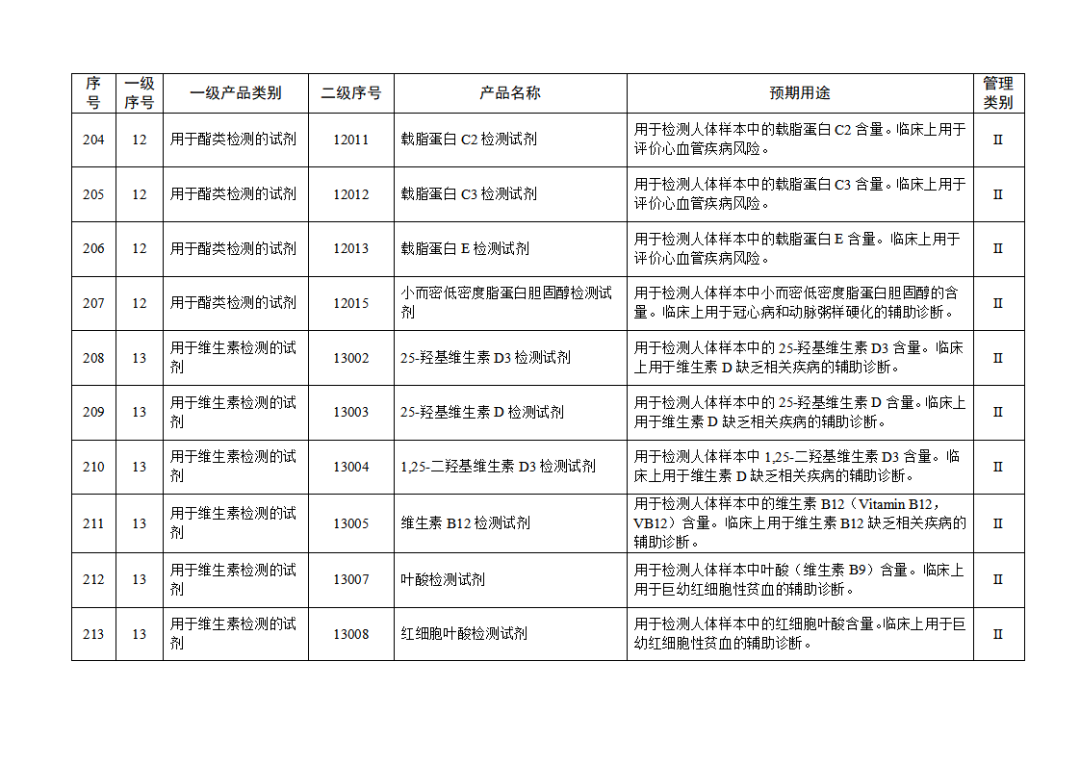
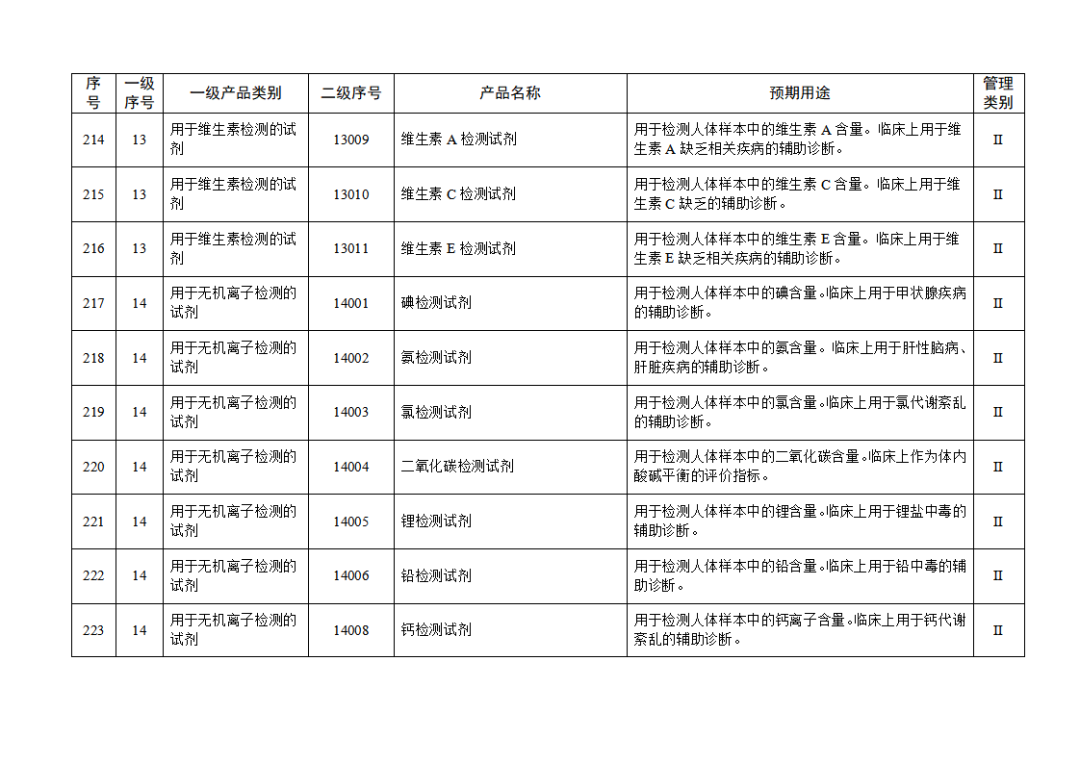
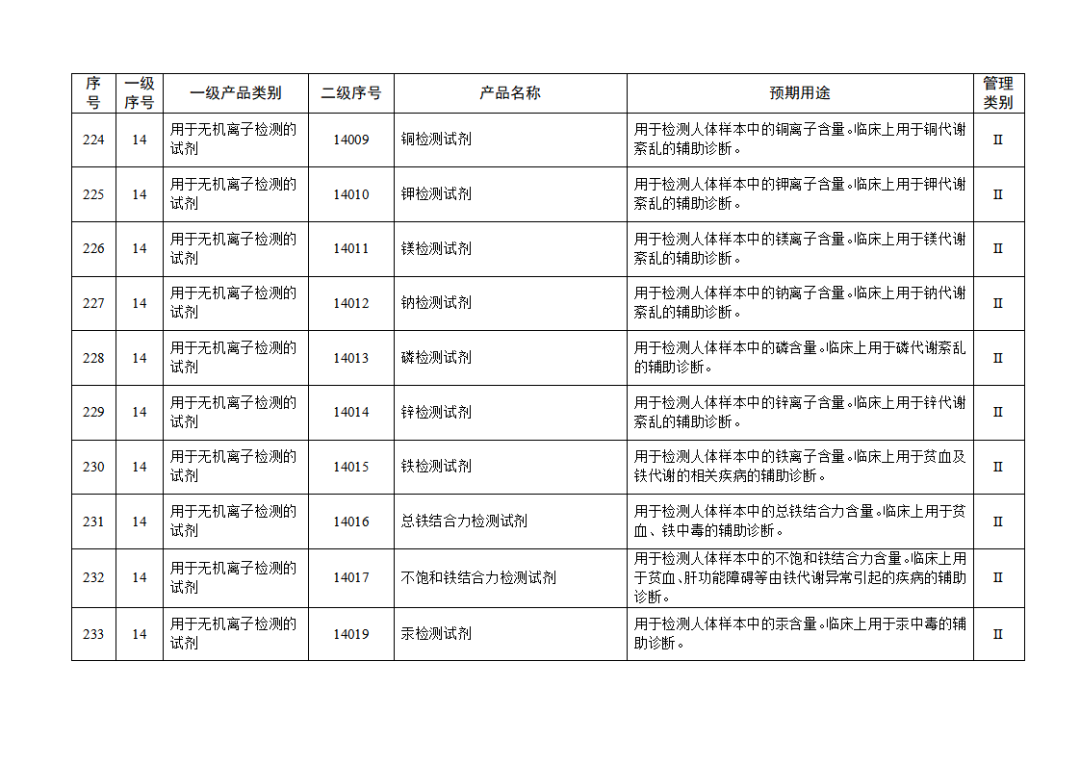
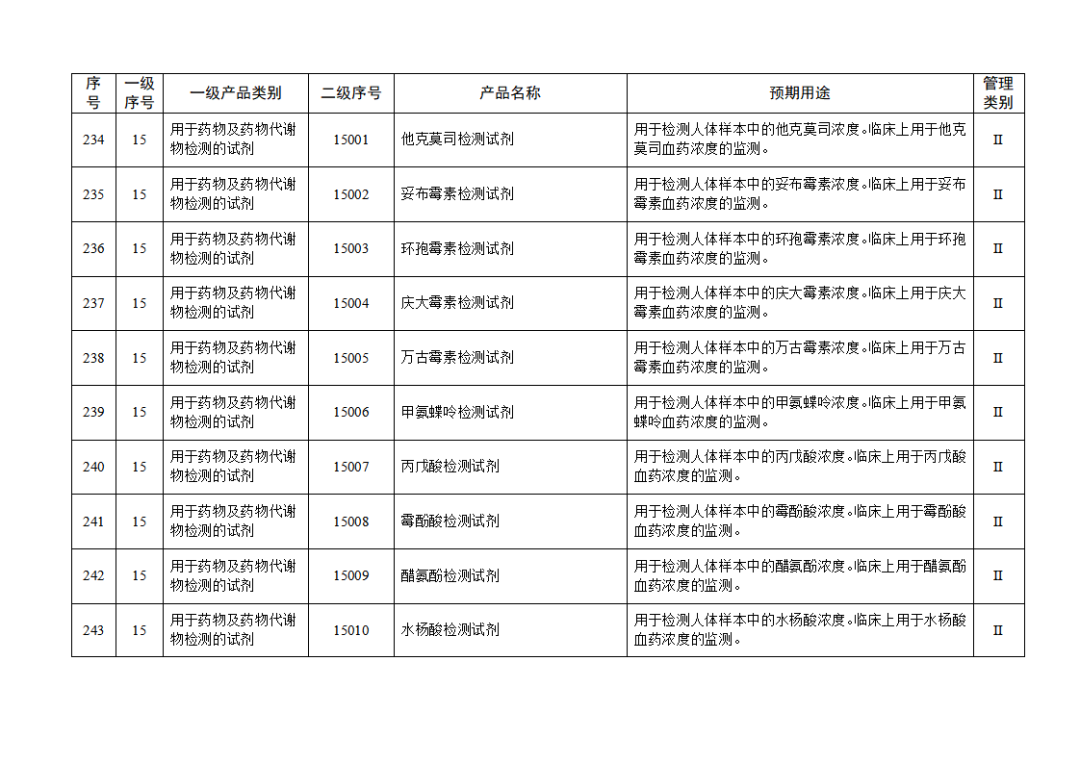
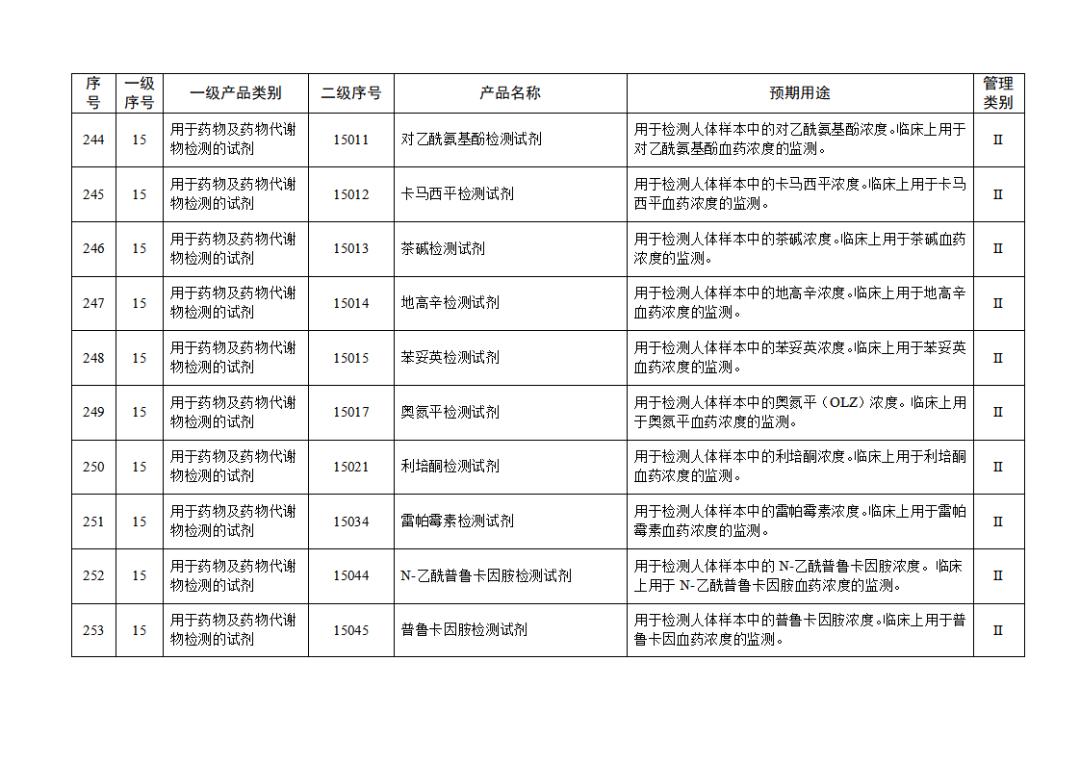
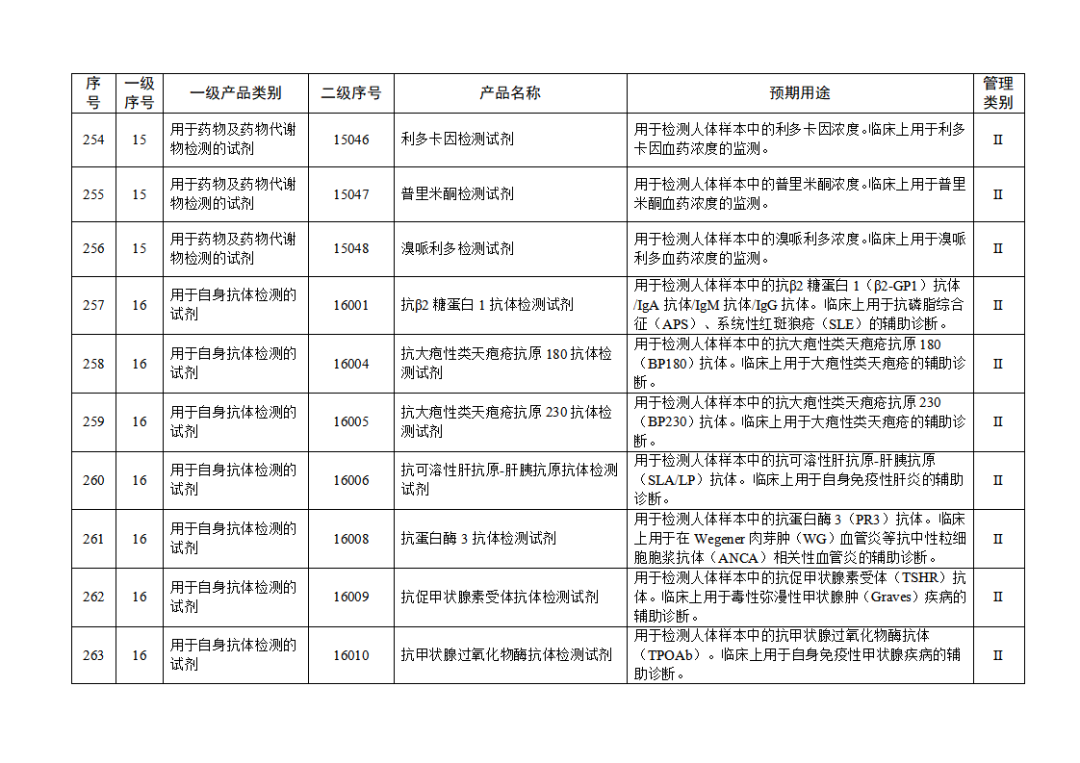
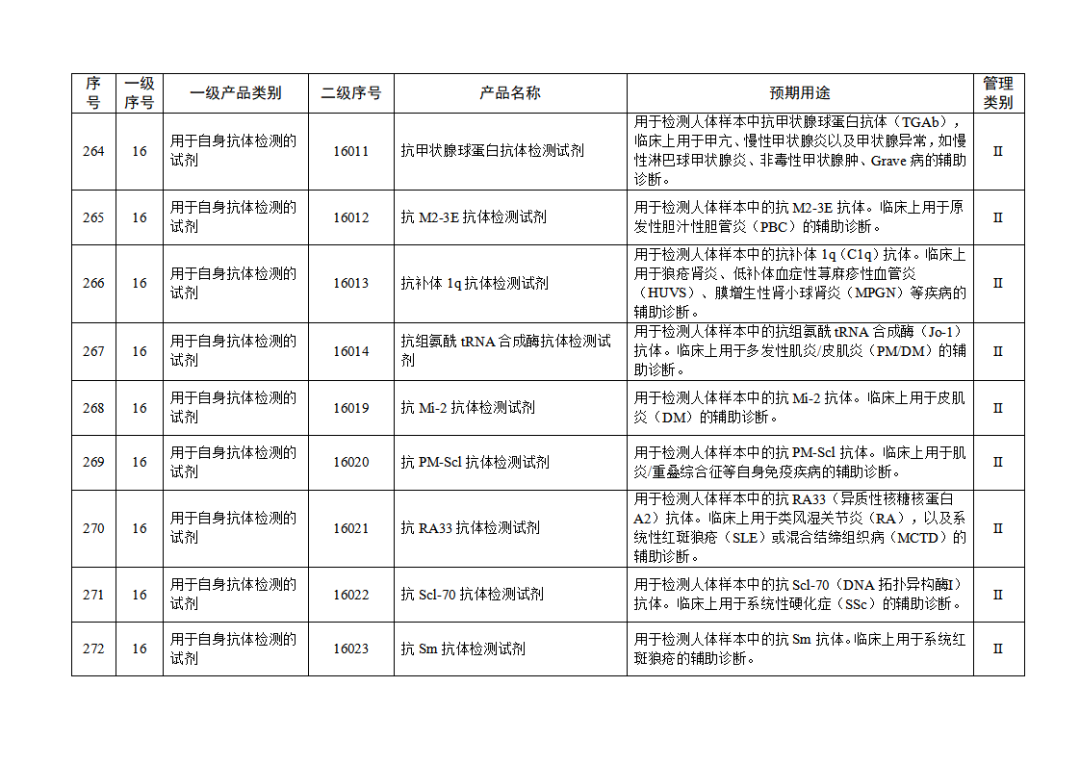
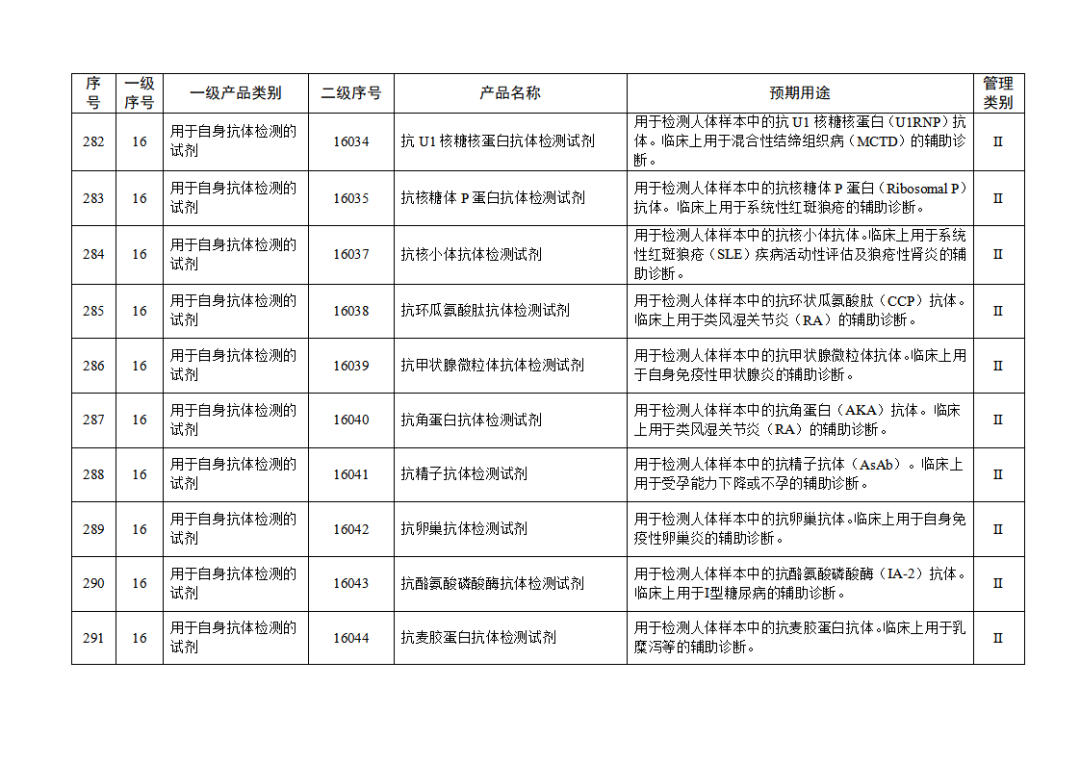
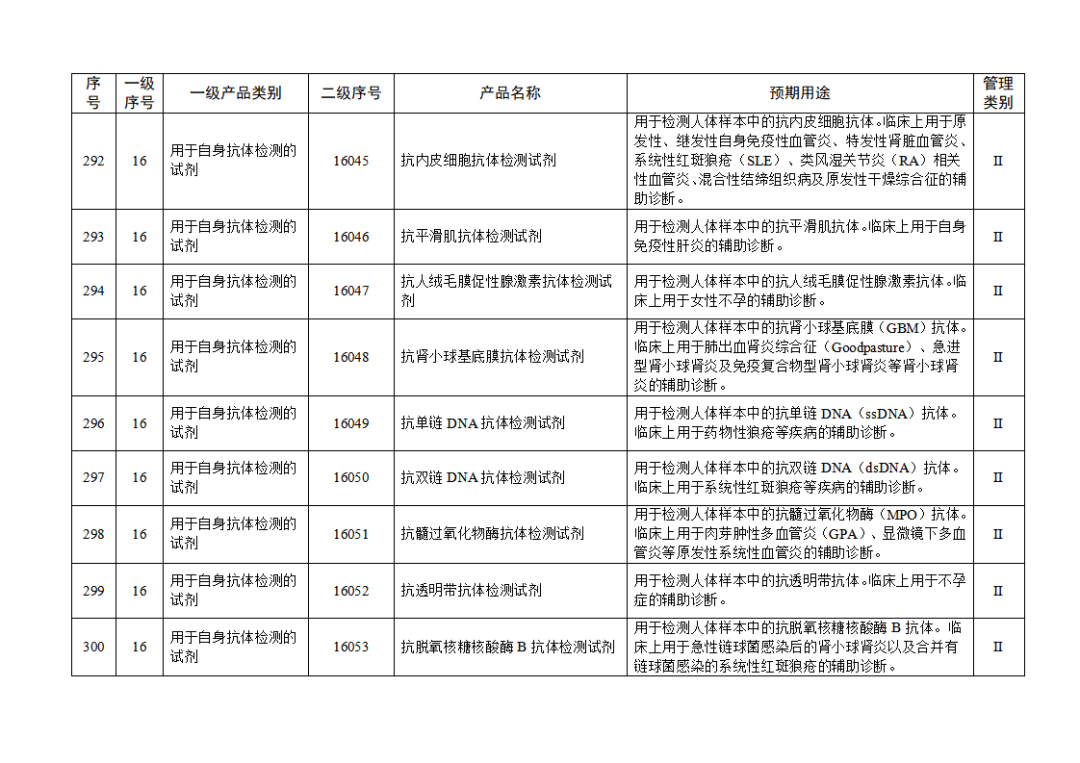
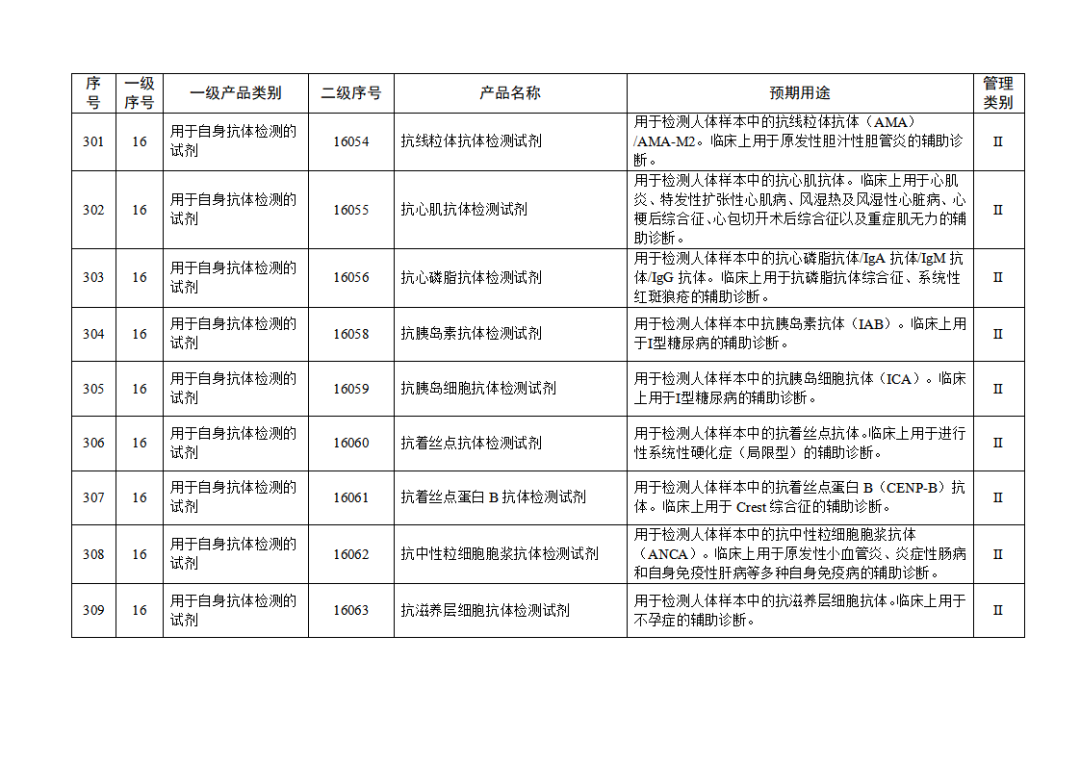
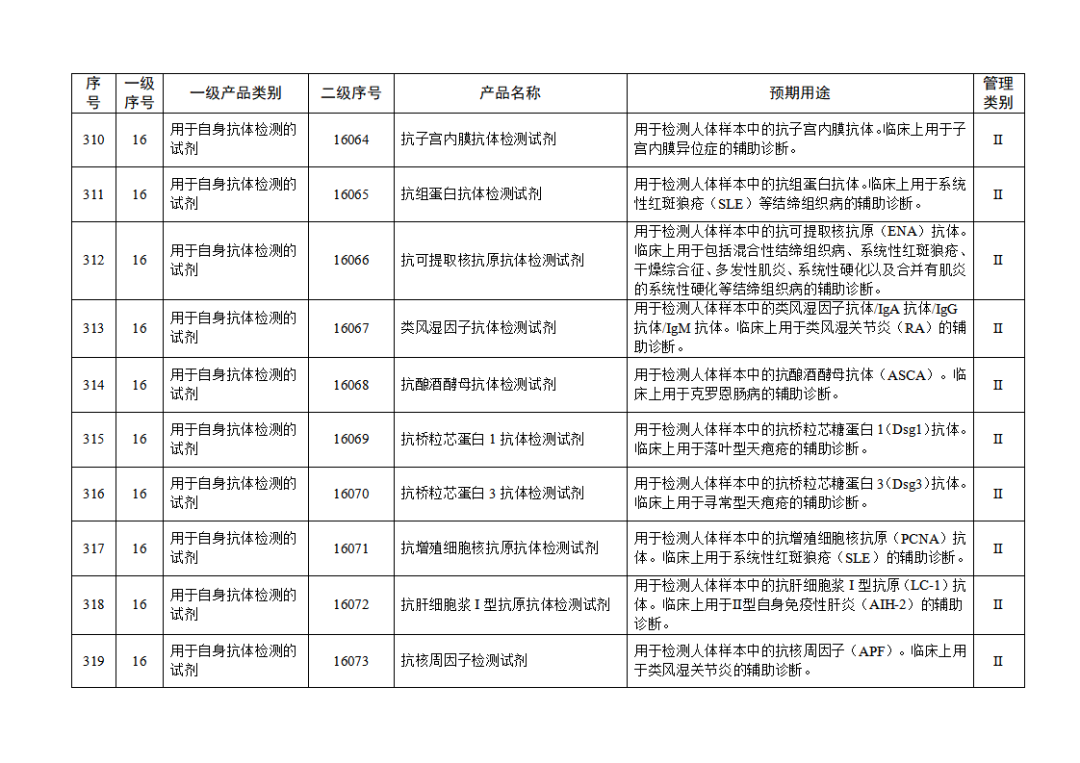
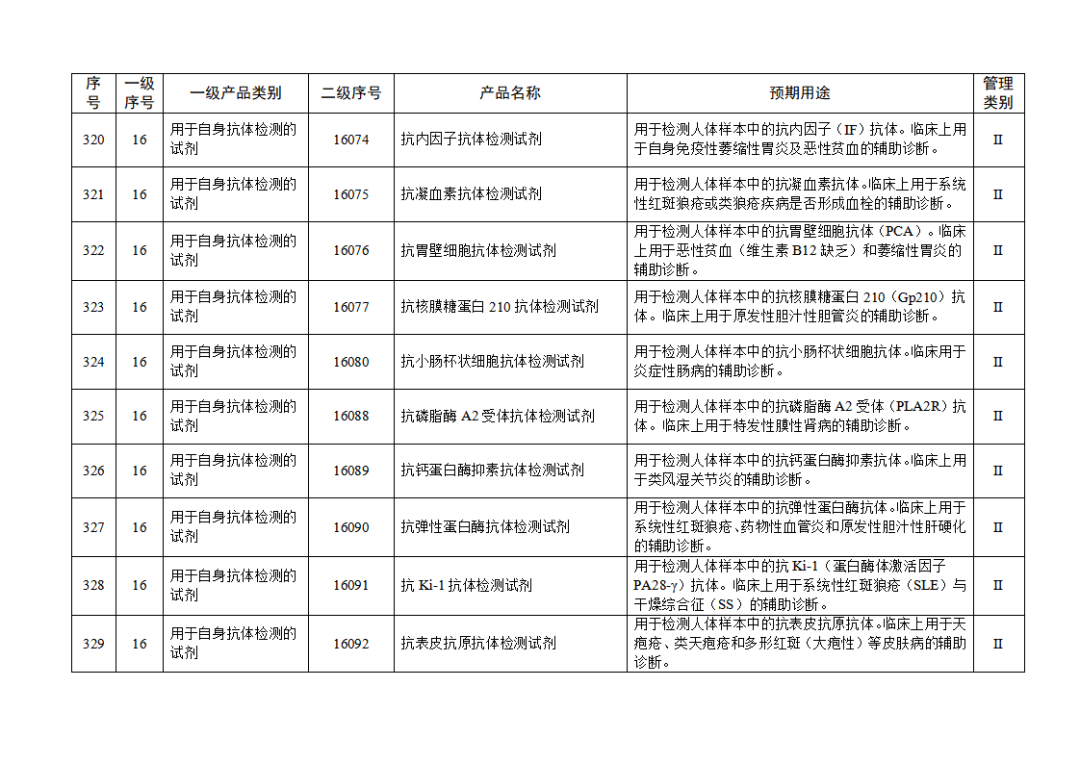
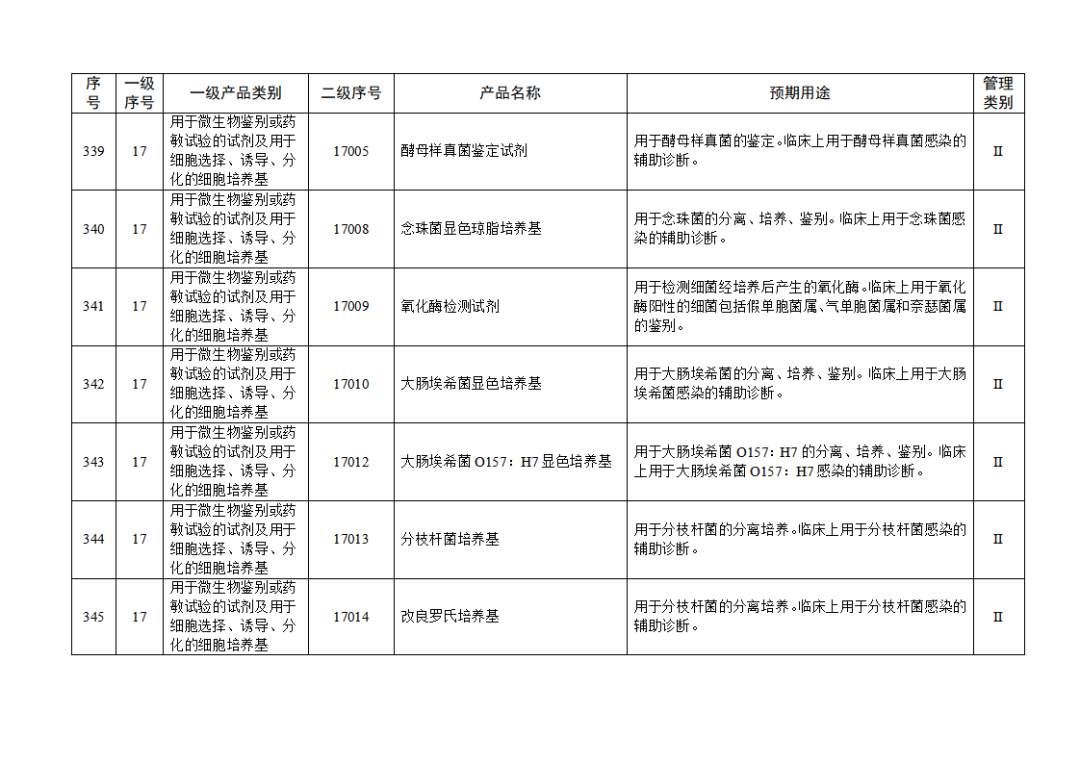
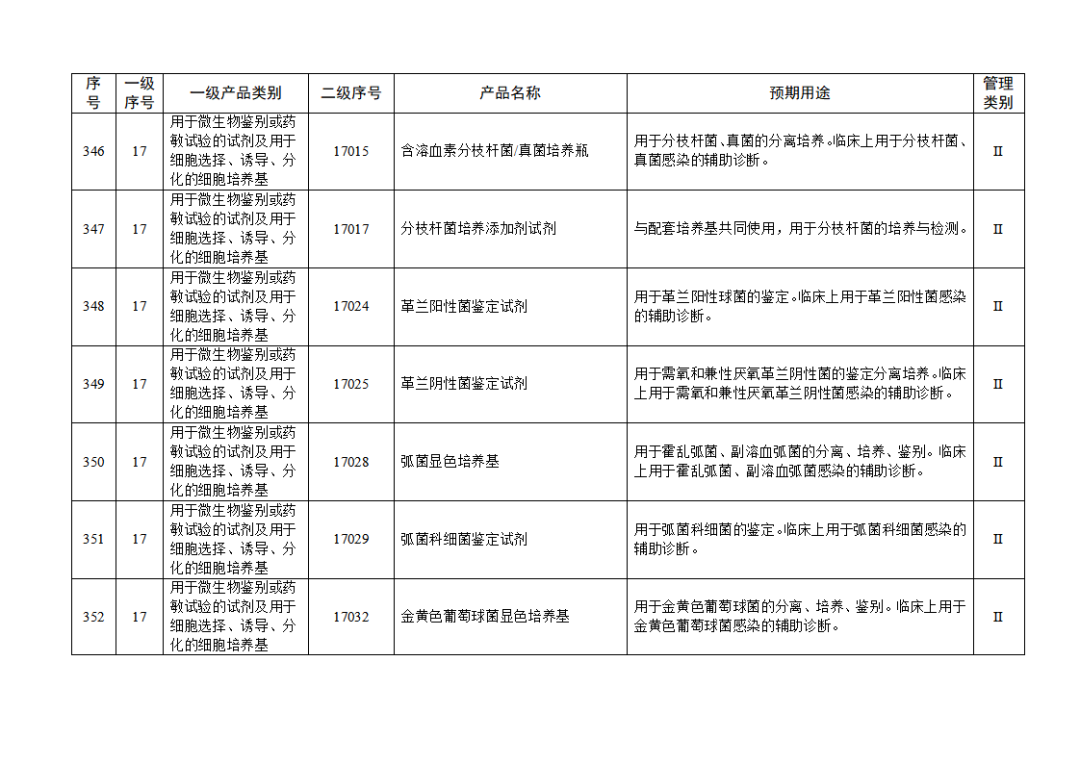
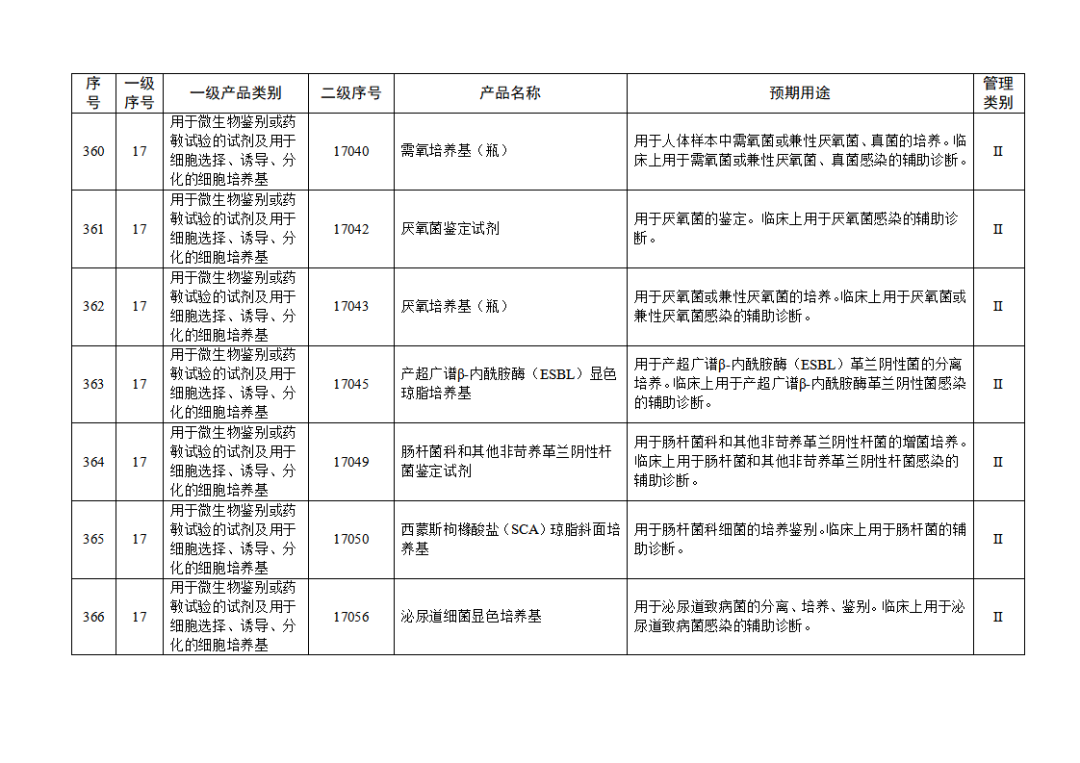
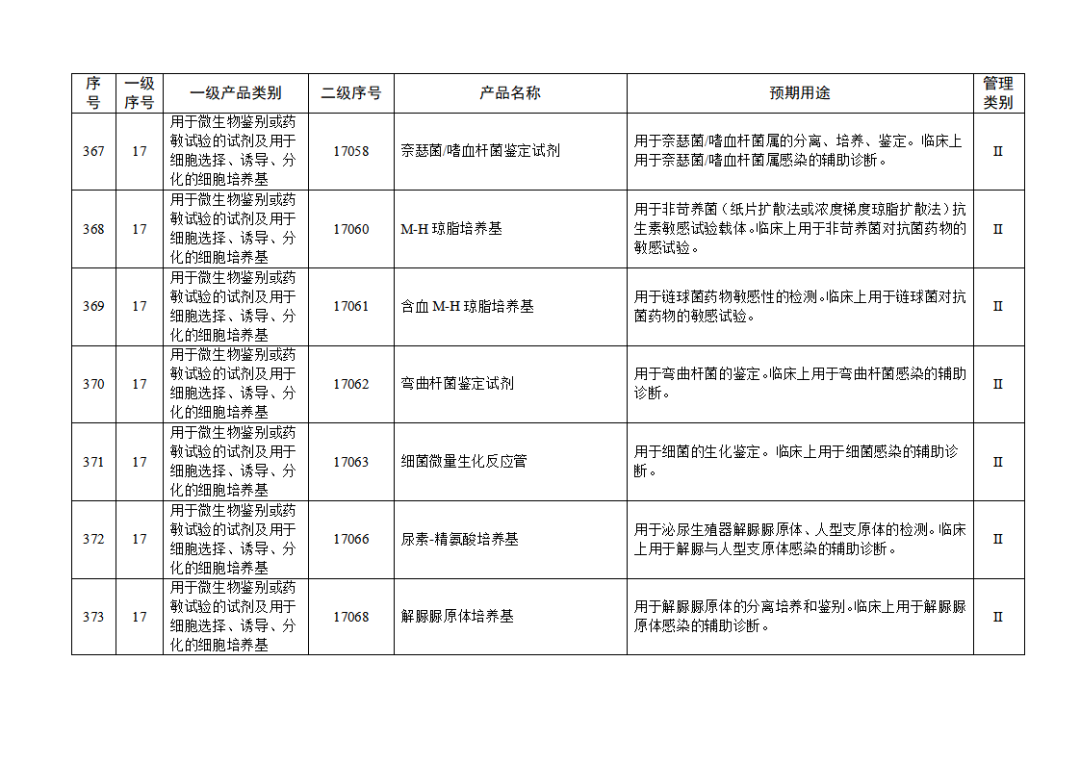
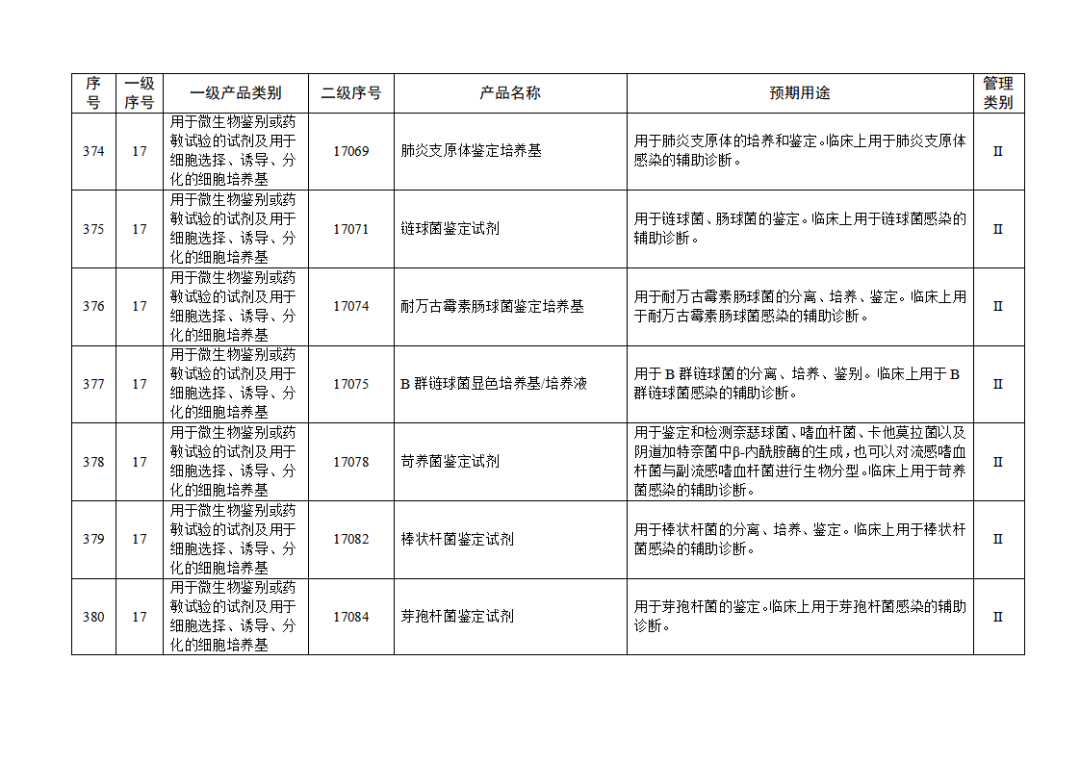
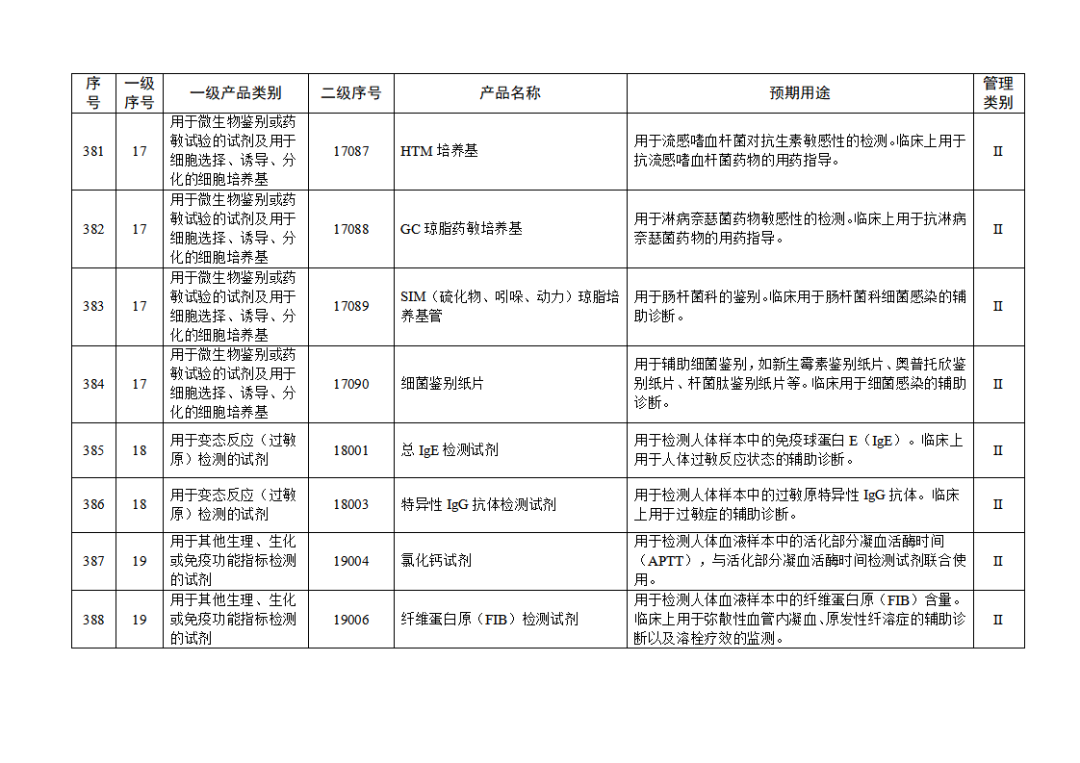
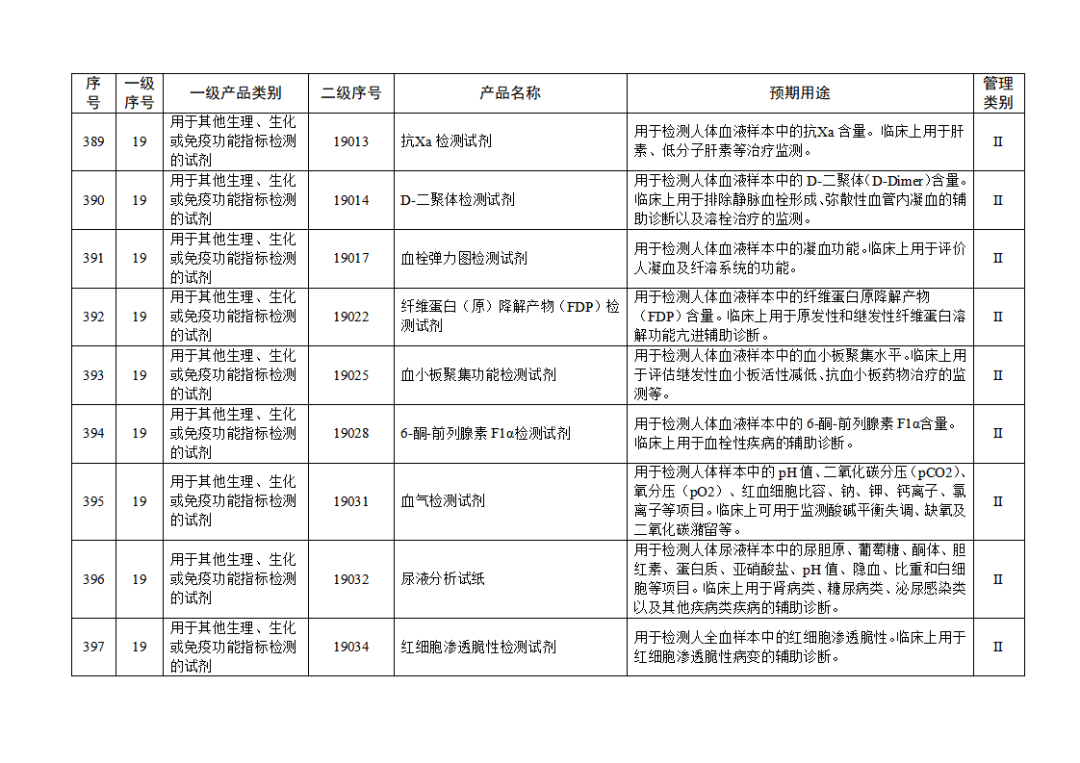
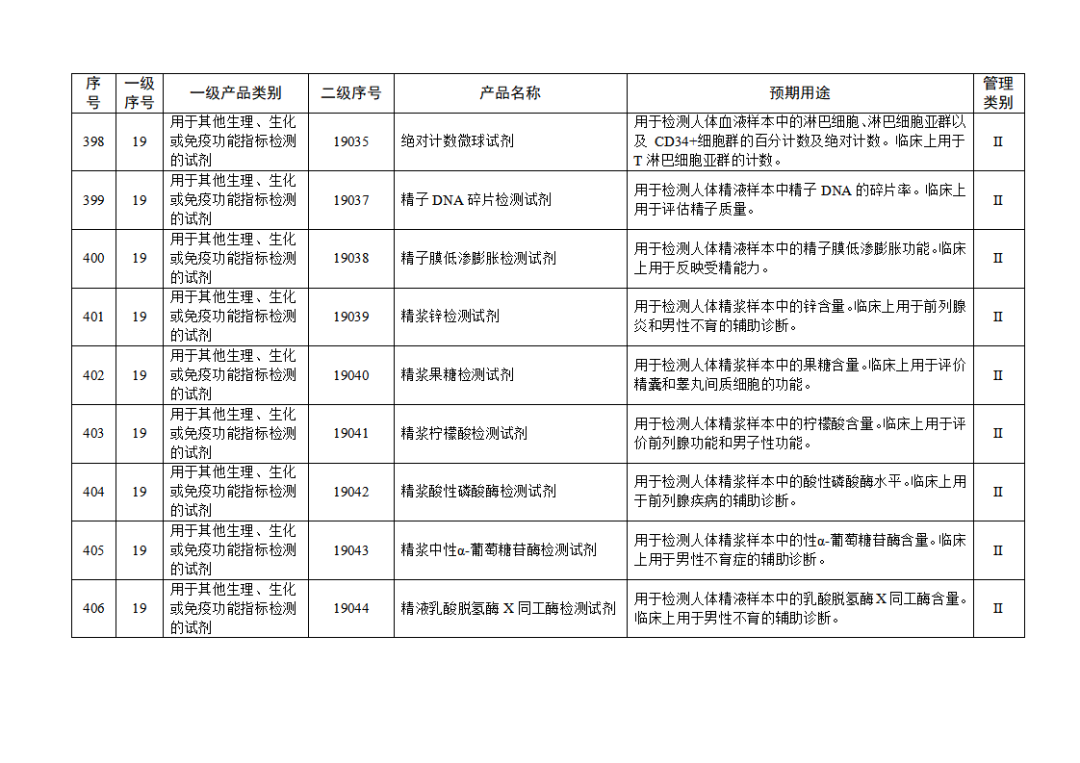
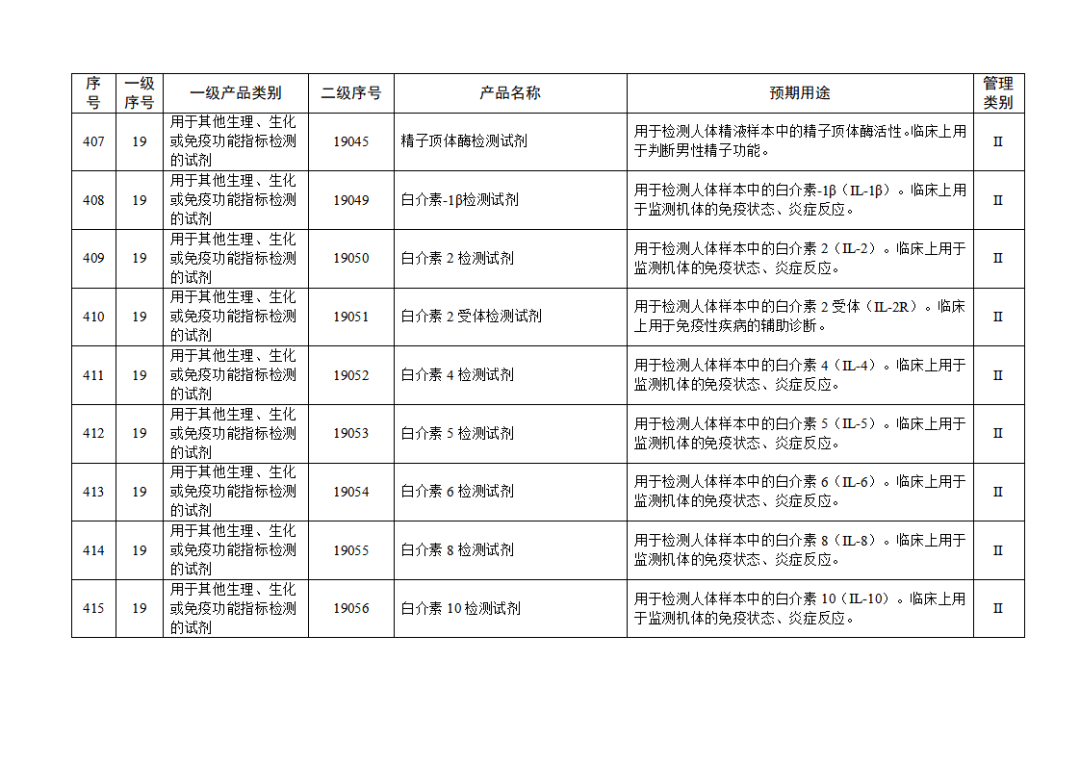
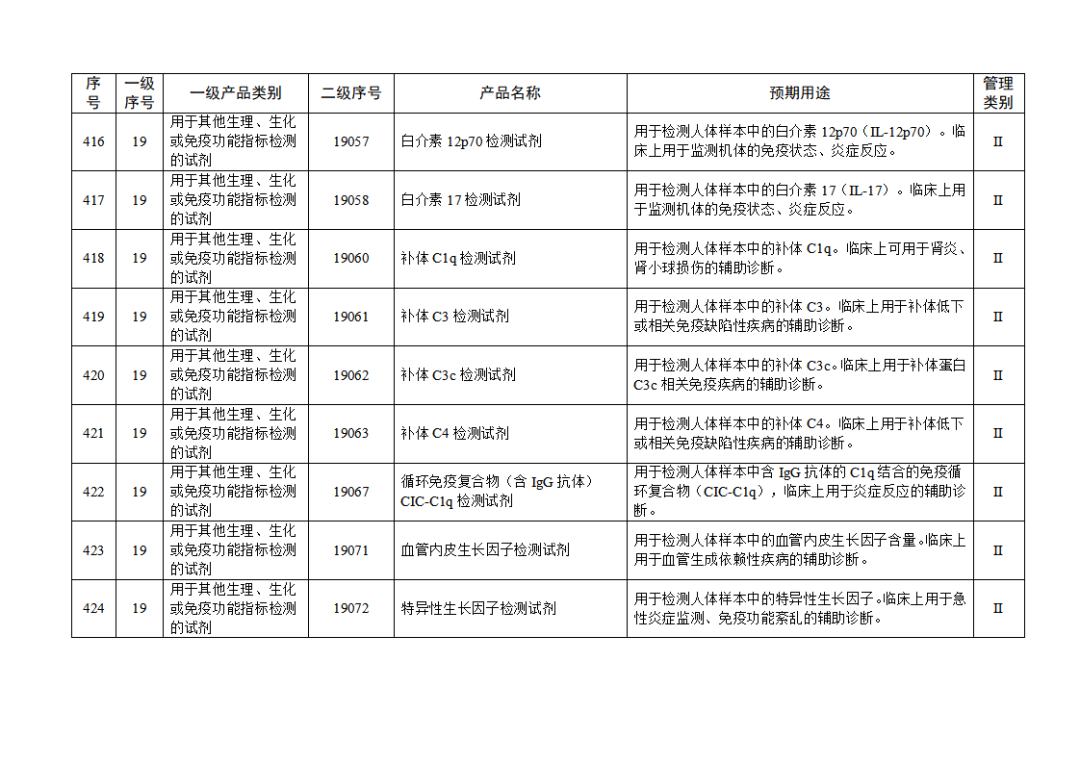
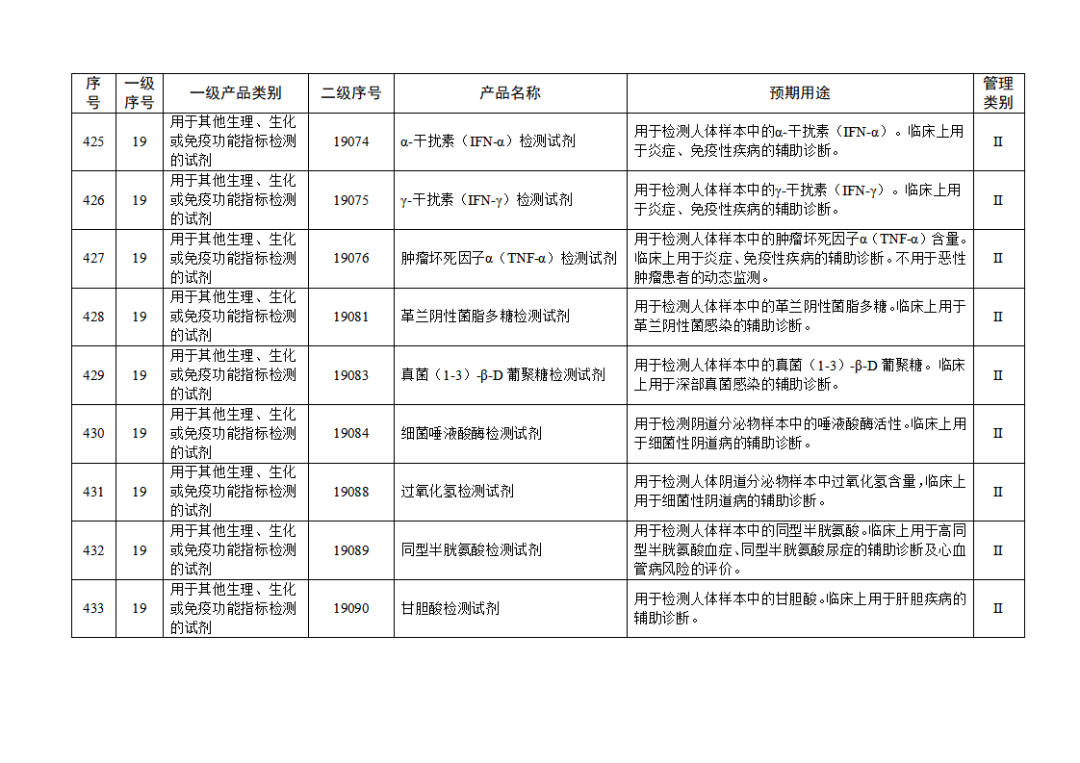
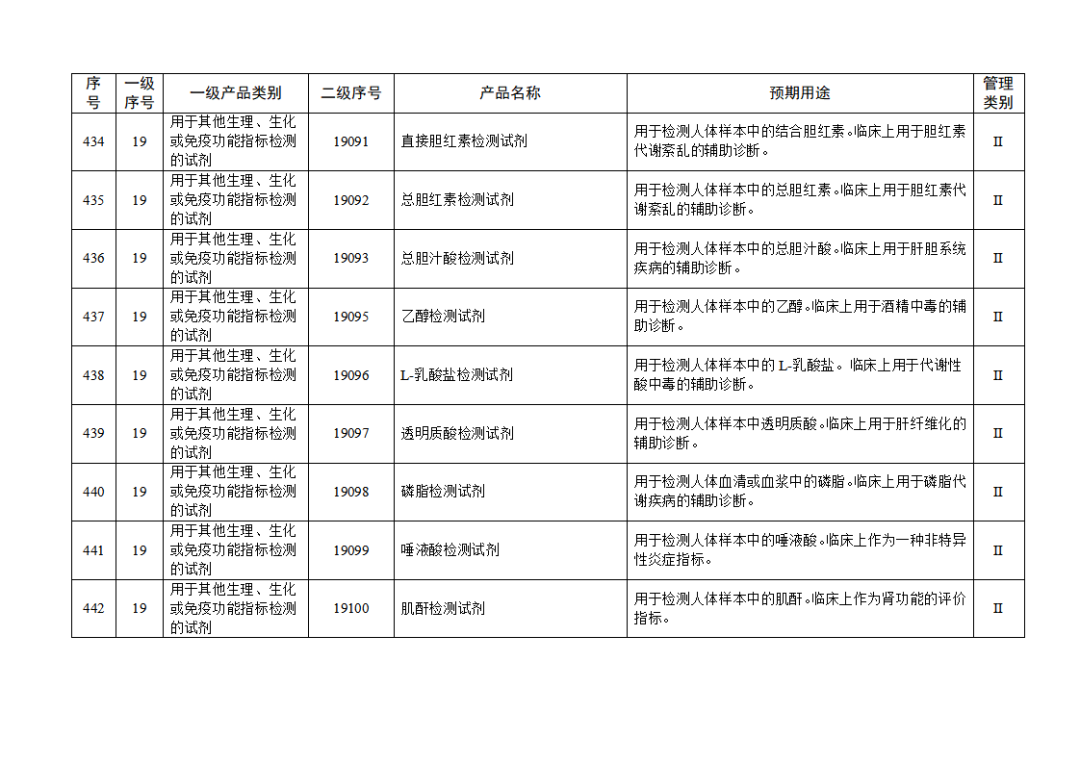
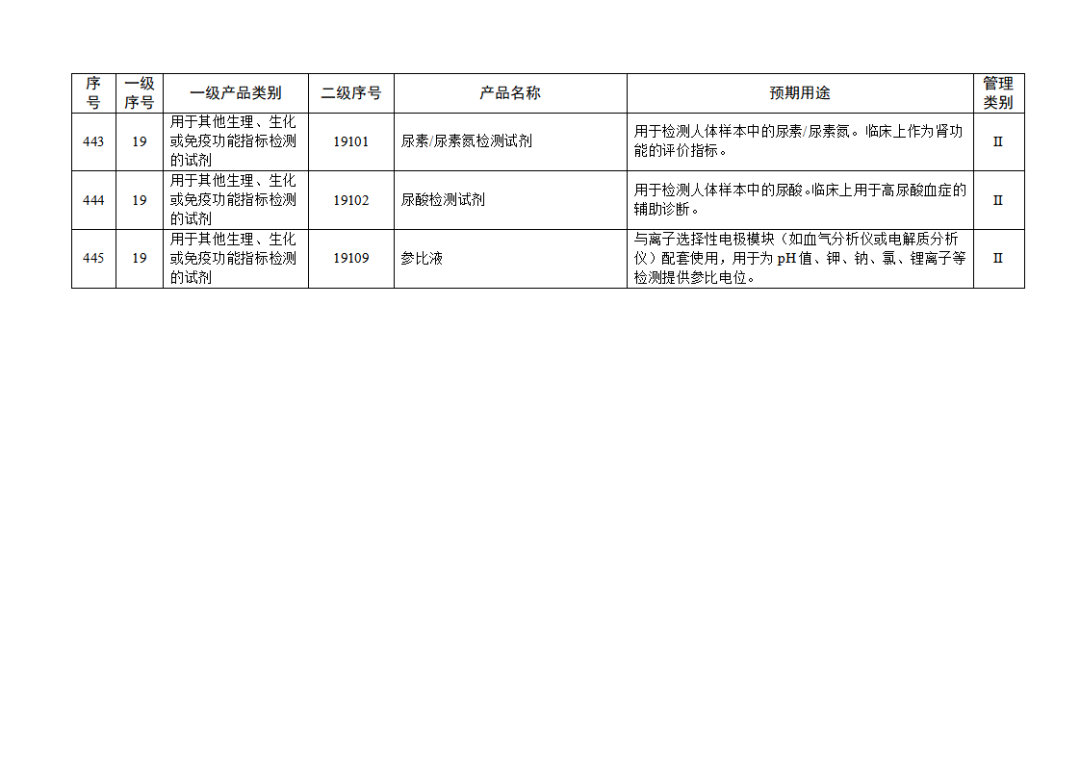
根據(jù)《體外診斷試劑注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第48號),國家藥監(jiān)局組織修訂了《免于進行臨床試驗體外診斷試劑目錄》(國家藥監(jiān)局通告2021年第70號),形成《免于進行臨床試驗體外診斷試劑目錄(2025年)》,現(xiàn)予公布,并自公布之日起施行。
特此通告。
附件:免于進行臨床試驗體外診斷試劑目錄(2025年).doc
國家藥監(jiān)局
2025年6月23日




站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責。圖片版權歸原作者所有,如有侵權請聯(lián)系我們,我們立刻刪除。如有關于作品內(nèi)容、版權或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應并做相關處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務服務,提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創(chuàng)新辦理服務。
《海南博鰲樂城國際醫(yī)療旅游先行區(qū)臨床急需進口藥品帶離先行區(qū)使用管理暫行辦法》已經(jīng)3月24日海南博鰲樂城國際醫(yī)療旅游先行區(qū)領導小組會議審議通過,現(xiàn)印發(fā)給你們,請遵照執(zhí)行

國家藥監(jiān)局關于發(fā)布免于進行臨床評價醫(yī)療器械目錄的通告(2025年第19號)發(fā)布時間:2025-05-13為做好醫(yī)療器械注冊管理工作,根據(jù)《醫(yī)療器械注冊與備案管理

為加強醫(yī)療器械生產(chǎn)監(jiān)督管理,規(guī)范醫(yī)療器械生產(chǎn)質(zhì)量管理,根據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務院令650號)、《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》(國家食品藥品監(jiān)督管理總局令第7號)

附件:醫(yī)療器械監(jiān)督管理條例(2025年修訂版).doc醫(yī)療器械監(jiān)督管理條例(2000年1月4日中華人民共和國國務院令第276號公布 2014年2月12日國務院第

國家藥監(jiān)局關于發(fā)布免于臨床試驗的體外診斷試劑臨床評價技術指導原則的通告(2021年第74號)發(fā)布時間:2021-09-24為指導體外診斷試劑的臨床評價工作,根據(jù)

國家藥監(jiān)局藥審中心關于發(fā)布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術指導原則》的通告(2024年第42號) 發(fā)布日期:20241010

為深化藥品審評審批制度改革,鼓勵創(chuàng)新,進一步推動我國藥物臨床試驗規(guī)范研究和提升質(zhì)量,國家藥品監(jiān)督管理局會同國家衛(wèi)生健康委員會組織修訂了《藥物臨床試驗質(zhì)量管理規(guī)范》

國家藥監(jiān)局器審中心關于發(fā)布影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)的通告(2024年第29號)發(fā)布時間:2024-10-14為進一步規(guī)范

為深化醫(yī)療器械審評審批制度改革,加強醫(yī)療器械臨床試驗管理,根據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務院令第739號)及《醫(yī)療器械注冊與備案管理辦法》(市場監(jiān)管總局令第47號)、《

國家藥品監(jiān)督管理局食品藥品審核查驗中心關于發(fā)布《藥物臨床試驗機構年度工作總結報告填報指南》的通告(2024年第1號)發(fā)布時間:2024-01-25為加強藥物臨床試驗機構監(jiān)督管理,規(guī)范年度工作總結報告的撰寫工作,國家藥品監(jiān)督管理局食品藥品審核查驗中心組織制定了《藥物臨床試驗機構年度工作總結報告填報指南》(見附件),經(jīng)國家藥品監(jiān)督管理局同意,現(xiàn)予發(fā)布。特此通告。附件:藥物臨床試驗機構年度工作總結報告填
行業(yè)資訊
?
?
?
?
?
?
知識分享
八年
醫(yī)療器械服務經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
