化妝品外包裝上的“國妝備進字”和“國妝網備進字”有什么區(qū)別?
化妝品外包裝上的國妝備進字和國妝網備進字有什么區(qū)別?國妝備進字和國妝網備進字,都是進口非特殊用途化妝品備案管理,只是由之前的國家藥品監(jiān)督管理部門受理備案(格式:國


注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2024-02-20 閱讀量:次
目前,國內主要的實驗室資質有CNAS及CMA兩種資質認定,CMA計量認證和CNAS實驗室認可作為檢測報告常用的認證,兩者之間既有相同之處,也存在著一些區(qū)別。作為國內主要可獲得的實驗室資質,CNAS和CMA究竟有什么區(qū)別?您的實驗室到底要拿到哪種資質比較合適?

CNAS是中國合格評定國家認可委員會的英文縮寫,是根據(jù)《中華人民共和國認證認可條例》的規(guī)定,由國家認證與認可監(jiān)督管理委員會(CNCA)批準設立并授權的國家認可機構,統(tǒng)一負責對認證機構、實驗室和檢驗機構等相關機構的認可工作。
CMA即實驗室資質認定,又稱計量認證,是依據(jù)《中華人民共和國計量法》、《中華人民共和國認證認可條例》等有關法律、法規(guī)的規(guī)定,對為社會出具公證數(shù)據(jù)的檢驗機構進行強制考核的一種手段,是政府對第三方實驗室的行政許可,是政府權威部門對檢測機構進行規(guī)定類型檢測所給予的正式承認。實驗室獲得資質認定證書,才具備向用戶、社會及政府提供公正數(shù)據(jù)的條件和資格。
我國實驗室資質認定,由國家認證認可監(jiān)督管理委員會(CNCA)統(tǒng)一管理,分國家和省兩級實施。國家認證認可監(jiān)督管理委員會統(tǒng)一管理、監(jiān)督和綜合協(xié)調實驗室的資質認定工作,國家級實驗室的資質認定由國家認監(jiān)委負責實施;各省、自治區(qū)、直轄市人民政府質量技術監(jiān)督部門和各直屬出入境檢驗檢疫機構按照各自職責負責所轄區(qū)域內的實驗室的資質認定和監(jiān)督檢查工作,地方級實驗室的資質認定,由地方質檢部門負責實施。
CNAS實驗室認可證書的評審組織機構和發(fā)證機構是中國合格評定國家認可委員會;
CMA分省級和國家級,國家級實驗室的資質認定由國家認監(jiān)委負責,非國家級的實驗室一般由所在地省級的質量技術監(jiān)督局負責組織評審和發(fā)證。
CNAS秉承的是自愿、非歧視的原則;
CMA是針對為社會出具公證數(shù)據(jù)的檢驗機構進行的強制考核。
CNAS認可對實驗室的法律地位沒有限制,可以是企業(yè)內部的實驗室,也可以是獨立的第三方實驗室;
CMA實驗室資質認定的對象,需要是獨立的第三方實驗室、政府相關部門下屬的事業(yè)單位實驗室等。
通過CNAS認可的實驗室在其認可范圍內出具的帶CNAS標識的報告,可在全球的多個國家和地區(qū)通行(雙方簽署了互認協(xié)議MRA);
通過CMA資質認定的實驗室在其認定范圍內出具的報告只在國內有效。
1.CMA和CNAS通用要求:公正性和保密性。
2.CMA和CNAS結構要求:能承擔法律責任,具有管理層和相應人員,在固定的的設施內實施計劃申請的檢測工作。
3.CMA和CNAS資源要求:包括人員、設施環(huán)境、設備(包括標準品/試劑/消耗品)、計量溯源性、外部提供的產品和服務等5方面要求。
4.CMA和CNAS過程要求:包括要求、標書和合同評審、方法選擇驗證確認、樣品、記錄、測量不確定度、結果有效性、報告、投訴、不符合工作及數(shù)據(jù)管理等10方面要求。
5.CMA和CNAS管理體系要求:包括體系文件、文件控制、記錄控制、應對風險和機遇的措施、改進、糾正措施、內審和管理評審等8方面要求。
體系文件分為四級,第一級是質量手冊,第二級是程序文件,第三級是作業(yè)指導書,第四級是記錄表格。
(1)CMA體系文件要求:質量手冊和程序文件的編寫依據(jù)是RB/T214-2017《檢驗檢測機構資質認定能力評價檢驗檢測機構通用要求》。
(2)CNAS體系文件要求:質量手冊和程序文件的編寫依據(jù)是CNAS-CL01:2018檢測和校準實驗室能力的通用要求。
作業(yè)指導書編制方法類、儀器設備操作類、期間核查類等作業(yè)指導書。記錄表格包括技術記錄表格、質量記錄表格等。
在編寫體系文件時要注意幾個方面。
第一,防止文件雷同。CMA/CNAS要求如果文件內容雷同,則不予認可。
第二,文件要符合領域要求。即文件的內容必須屬于本檢測領域。
第三,文件之間有要有銜接。
第四,不可隨便添加手冊編寫依據(jù)。
6.CMA和CNAS體系運行要求:體系初次認可必須運行半年以上。包括人、機、料、法、環(huán)、測的準備,體系文件的編制和發(fā)布,待體系文件發(fā)布后再開始體系運行,在運行過程中邏輯清晰、運行有效等。體系運行原則是全員參與、各負其責、相互協(xié)作、共同改進。設定崗位包括中心主任、技術負責人、質量負責人、業(yè)務室負責人,檢驗員、內審員、監(jiān)督員、授權簽字人等,在體系運行的過程中要全員參與其中、各負其責,相互協(xié)作,以推動質量管理體系更好的運行。
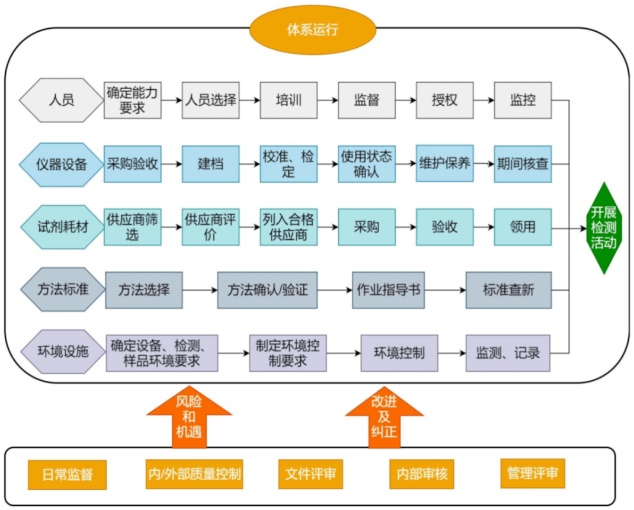
體系運行的流程
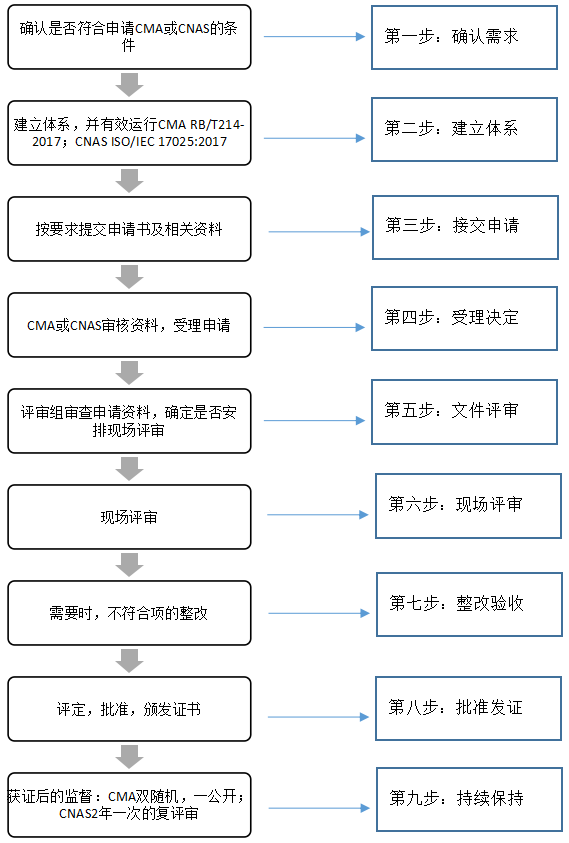
評審組依據(jù)CNAS-CL01:2018《檢測和校準實驗室能力認可準則》要求,對實驗室環(huán)境進行查看,對檢測人員、授權簽字人及各關鍵崗位人員以提問、筆試、現(xiàn)場試驗和召開座談會等形式進行考核,并對技術文件、原始記錄和質量管理體系的運行情況進行全面細致的檢查。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯(lián)系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發(fā)表后的30日內與本站聯(lián)系,本網將迅速給您回應并做相關處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產品政策與法規(guī)規(guī)事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創(chuàng)新辦理服務。

化妝品外包裝上的國妝備進字和國妝網備進字有什么區(qū)別?國妝備進字和國妝網備進字,都是進口非特殊用途化妝品備案管理,只是由之前的國家藥品監(jiān)督管理部門受理備案(格式:國

在購買面膜的時候,通常會看看產品外包裝,標注的械字號還是妝字號。械字號面膜通常注冊申報為醫(yī)用冷敷貼,具備特殊的治療功能。而妝字號面膜是不允許有治療功能的。除了這個

GMP、GLP和GCP是什么?GMP(GOOD MANUFACTURING PRACTICE)良好生產規(guī)范:世界衛(wèi)生組織將GMP定義為指導食物、藥品、醫(yī)療產品生產和質量管理的法規(guī)。GMP要求制藥、食品等生產企業(yè)應具備良好的

不良事件(Adverse Event,AE)是指在臨床試驗中受試者發(fā)生的任何可能與試驗治療及試驗用藥品/醫(yī)療器械有關或不一定有關的醫(yī)療事件。嚴重不良事件(Serious Adverse Event,SAE)指在任何藥物

化妝品包裝上常看到國妝特字、國妝特進字、衛(wèi)妝特字、衛(wèi)妝特進字、衛(wèi)妝進字、 衛(wèi)妝備進字、國妝備進字的字樣,是不是都被繞暈了,不知道是什么意思?可以查看化妝品批準文號和

為落實好總局《關于整治醫(yī)療器械流通領域違法經營行為的公告》,浙江省藥監(jiān)局要求各市局統(tǒng)一培訓檢查人員,統(tǒng)籌組織力量,采取異地交叉檢查方式,有針對性、有重點地實施監(jiān)督

近期,部分新涉足醫(yī)療器械行業(yè)的朋友咨詢到醫(yī)療器械經營許可證與醫(yī)療器械經營備案憑證的區(qū)別,在此,從以下幾個方面來說明醫(yī)療器械經營備案憑證和醫(yī)療器械經營許可證的異同,

CMA是China Inspection Body and Laboratory Mandatory Approval的英文縮寫,稱作實驗室資質認定。是依據(jù)《中華人民共和國計量法》、《中華人民共和國認證認可條例》等有關法律、法規(guī)的規(guī)定,對為

在醫(yī)療領域,特定設備或系統(tǒng)的運作方式往往是醫(yī)學工程師和科研人員共同關注的焦點。然而,在深入研究過程中,我們發(fā)現(xiàn)“工作原理”和“作用機理”這兩個術語之間存在著微妙而重要的區(qū)別。拿藥物球囊擴張導管產品為例,我們可以深入探討這兩個概念在該產品中的體現(xiàn)。工作原理工作原理主要著眼于設備或系統(tǒng)的運作方式,即在實際操作中,它是如何完成任務的。對于藥物球囊擴張導管產品而言,其工作原理可以簡單概括為通過球囊的擴張力

“撤回知情同意”、“撤回知情”、“撤回同意”哪一種說法更嚴謹一些?“withdraw consent”直譯為“撤回同意”,知情是已發(fā)生的既定事實,無法被撤回;能
行業(yè)資訊
?
?
?
?
?
?
知識分享
八年
醫(yī)療器械服務經驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
